氨在国民经济中占有重要的地位,2008年,我国氨产量接近500万吨.下图是合成氨的简要流程.
(1)下表是空气中部分气体的沸点.将空气液化加热分馏,依据下表数据判断,最先气化得到的气体是
氦气
氦气
.
| 气体名称 |
氨气 |
氧气 |
氦气 |
氖气 |
氩气 |
氪气 |
氚气 |
| 沸点/℃ |
-196 |
-183 |
-269 |
-264 |
-186 |
-153 |
-108 |
(2)天然气、重油、煤都可以与水反应制得氢气.下表是某合成氨厂采用不同原料的相对投资和能量消耗.
| 原料 |
天然气 |
重油 |
煤 |
| 相对投资费用 |
1.0 |
1.5 |
2.0 |
| 能量消耗/J?t-1 |
28×109 |
38×109 |
48×109 |
①依据上表信息,你认为采用
天然气
天然气
为原料最好.
②请写出甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳的化学方程式:
.
③已知C(s)、CO(g)和H
2(g)完全燃烧的热化学方程式分别为:
C(s)+O
2(g)═CO
2(g)△H=-394kJ?mol
-1;
2CO(g)+O
2(g)═2CO
2(g)△H=-566kJ?mol
-1;
2H
2(g)+O
2(g)═2H
2O(g)△H=-484kJ?mol
-1;
试写出由C于水蒸气在高温条件下反应生成氢气与一氧化碳的热化学方程式
C(s)+H2O(g)=CO(g)+H2(g)△H=+131kJ?mol-1
C(s)+H2O(g)=CO(g)+H2(g)△H=+131kJ?mol-1
.
(3)下表是在某种催化剂作用下用体积比为1:3的氮、氢混合气反应应达到平衡时的一些实验数据.
NH3含量%
压强/MPa
温度/℃ |
0.1 |
10 |
20 |
30 |
60 |
100 |
| 200 |
15.3 |
81.5 |
86.4 |
89.9 |
95.4 |
98.8 |
| 300 |
2.2 |
52.0 |
64.2 |
71.0 |
84.2 |
92.6 |
| 400 |
0.4 |
25.1 |
38.2 |
47.0 |
65.2 |
79.8 |
| 500 |
0.1 |
10.6 |
19.1 |
26.4 |
42.2 |
57.5 |
| 600 |
0.05 |
4.5 |
9.1 |
13.8 |
23.1 |
31.4 |
①依据表中数据判断,合成氨反应N
2+3H
2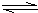
2NH
3的△H
<
<
(填“>”、“<”或“无法判断”)0,请简要说明理由
相同条件下,升高温度,NH3含量减小,平衡左移,逆反应吸热,正反应放热
相同条件下,升高温度,NH3含量减小,平衡左移,逆反应吸热,正反应放热
;
②该反应的化学平衡常数表达式为
.
③在300℃、10MPa下,合成氨反应达到平衡时,混合气体的体积是反应开始时的
0.66
0.66
倍.


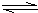 2NH3的△H
2NH3的△H