
题目列表(包括答案和解析)
| 酸 | 电离方程式 | 电离平衡常数Ka |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 |
| H2S | H2S?H++HS- HS-?H++S2- | Ka1=9.1×10-8 Ka2=1.1×10-12 |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- | Ka1=7.52×10-3 Ka2=6.23×10-8 Ka3=2.20×10-13 |
| 城市 | 污染指数 | 首要污染物 | 空气质量等级 | ||
| SO2 | NO2 | PM10 | |||
| A | 98 | 23 | 67 | SO2 | Ⅱ |
| B | 47 | 29 | 35 | SO2 | Ⅰ |
| C | 62 | 40 | 113 | PM10 | Ⅲ |
| D | 42 | 76 | 59 | NO2 | Ⅰ |
| 酸 | 电离方程式 | 电离平衡常数Ka |
| CH3COOH | CH3COOH?CH3COO-+H+ | 1.76×10-5 |
| H2S | H2S?H++HS- HS-?H++S2- |
Ka1=9.1×10-8 Ka2=1.1×10-12 |
| H3PO4 | H3PO4?H++H2PO4- H2PO4-?H++HPO42- HPO42-?H++PO43- |
Ka1=7.52×10-3 Ka2=6.23×10-8 Ka3=2.20×10-13 |
100g无水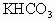 与
与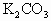 的混合物,在加热至质量恒定时,产生13.2g
的混合物,在加热至质量恒定时,产生13.2g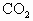 ,则混合物中
,则混合物中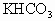 的质量分数是
的质量分数是
[ ]
100g无水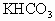 与
与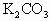 的混合物,在加热至质量恒定时,产生13.2g
的混合物,在加热至质量恒定时,产生13.2g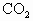 ,则混合物中
,则混合物中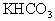 的质量分数是
的质量分数是
[ ]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com