
题目列表(包括答案和解析)
 下列用字母表示的是初中化学常见的物质,可能由H、C、O、Na、S、Ca、Fe中的几种元素组成.
下列用字母表示的是初中化学常见的物质,可能由H、C、O、Na、S、Ca、Fe中的几种元素组成.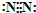
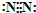
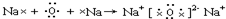
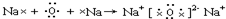
钢铁是使用最多的金属材料。
(1)铁制品锈蚀的过程,实际上是铁与 发生化学反应的过程。铝比铁活泼,但铝具有很好的抗腐蚀性能,其原因是 。
(2)将磁铁矿(主要成分是Fe3O4)冶炼成铁的化学方程式是 。生铁冶炼成钢的过程中,含碳量适当 (选填“升高”或“降低”)。
(3)实验室模拟炼铁原理进行实验,得到的尾气是CO和CO2的混合气体。现欲利用右图装置将该混合气体进行分离,图中a、b、c、d均为活塞。
①检查装置的气密性。
甲、乙、丙装置内放入一定量水,使长导管口浸没在水面以下,关闭b、c,打开a、d,并在最右端导管口接注射器。当向外缓慢拉动注射器活塞时,如果整套装置气密性良好,则能观察到的现象是 。
②分离CO和CO2的混合气体。
可供选择的试剂有:稀硫酸、浓硫酸、氢氧化钠溶液、澄清石灰水。
步骤Ⅰ:关闭b、c,打开a、d,缓缓通入混合气体,甲中发生反应的化学方程式为
;若乙装置中的现象是 ,说明甲装置中的反应是充分的;丙中试剂为 。通过此步实验,分离出的气体是 。
步骤Ⅱ:关闭 ,打开 ,让分液漏斗中的稀硫酸缓缓流下至不再产生气泡时,关闭b。通过此步实验,即可分离出另一种气体。
(4)铁元素可以形成3种氧化物,分别是FeO、Fe2O3和Fe3O4。取29g由铁和氧两种元素组成的固体样品,在高温时与足量CO充分反应,生成的气体被足量澄清石灰水吸收,得到50g沉淀。由此分析,原样品可能是 (选填字母)。
| A.Fe2O3 | B.Fe3O4 | C.FeO和Fe3O4的混合物 | D.Fe2O3和FeO的混合物 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com