
题目列表(包括答案和解析)
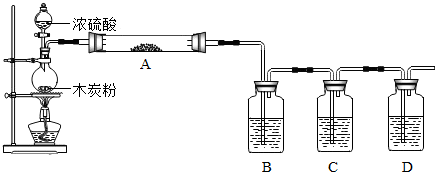
| ||
| ||

| ||
| ||
| ||
| ||

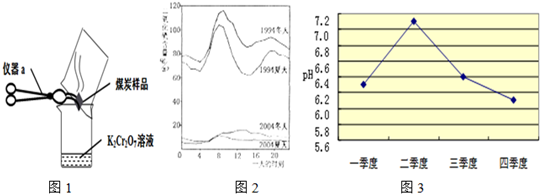
| ||
| ||
 +H2O”.然而化学方程式中有一生成物不清楚,请根据已学知识推测其化学式:
+H2O”.然而化学方程式中有一生成物不清楚,请根据已学知识推测其化学式:| 测定时间/分钟 | 0 | 1 | 2 | 3 |
| pH | 4.73 | 4.62 | 4.56 | 4.55 |
一、选择题(本题20分)每题只有一个正确答案,将其标号填在下表中。每题2分。
题号
1
2
3
4
5
6
7
8
9
10
答案
B
B
C
C
D
C
D
B
A
C
二、选择题(本题共10分)每题有1~2个正确答案,将其标号填在下表中。每题2分。正确答案只有一个选项的,多选不给分;正确答案包括两个选项的只选一个且正确给1分,一对一错不给分。
题号
11
12
13
14
15
答案
BD
A
AC
B
C
三、(本大题共6题 共15分)
16.(4分)每空1分。(1)NaCl (2)+5 (3)醋酸 (4)CH4
 17.(2分)每空1分。(1)分子在永不停息的做着无规则运动(2)分子间有间隙
17.(2分)每空1分。(1)分子在永不停息的做着无规则运动(2)分子间有间隙
18.(4分)每空1分。2Cl 2O2 2Fe2+ Ca
19.(1分)每空1分。0.3%
20.(2分)每空1分。30 120
21.(2分)每空1分。(1)34(2)C
22.(4分)每空1分。 2Mg+O2=====2MgO ;2KMnO4===== K2MnO4+MnO2+O2↑;
Mg+2HCl=====MgCl2+H2↑;Fe(OH)3+3HCl=====FeCl3+3H2O
23.(4分)每空1分。(1)A (2)b 升高温度 加水
24.(7分)每空1分。不成立;成立;不成立;产生白色沉淀;每种物质1分,NaOH
Na2CO3
五、(本大题共2题 共14分)
25.(9)每空1分。(1)每种物质1分, NH3;SO2 H2S (2)①木炭 ②氧化铜 ③铜
(3)CaO+H2O===Ca(OH)2;Na2CO3+Ca(OH)2== CaCO3↓+ 2NaOH;DEF
26.(5分)每空1分。A CH4; C CO2; D CO; 甲 O2; 乙 H2
六、(本大题共3题 共16分)
27.(3分)每空1分。A HCl 或MgCl2 ;B Na2SO4 ;C CaCl2 或HCl
28.(8分)每空1分。(1)吸附;物理 AgNO3+HCl===AgCl↓+HNO3(2)O2;50
(3)①酚酞试液,其他合理答案均给分。②FeCl3+3NaOH===Fe(OH)3↓+3NaCl
③Na2CO3+2HCl===2NaCl+H2O+CO2↑
29.(5分)①每种物质1分。C CuO Fe2O3
②每种物质检验的实验步骤,实验现象,结论正确1分。其他合理答案均给分。
实验步骤
实验现象
得出结论
取原混合物加入足的稀硝酸
若产生气泡
原混合物含有碳酸钙
若无气泡产生
原混合物不含有碳酸钙
向上述反应后的溶液中加入硝酸银溶液
若产生沉淀
原混合物含有氯化钠
若无沉淀产生
原混合物不含有氯化钠
七、计算题(本大题共2题 共10分)
30.(4分)解:
氧化铁的质量为8000┧×(1―20%)=6400┧ …………1分
|