
22.(14分)今有某碱金属R及其氧化物R2O的混合物
21.(6分)有
20.(6分)有一包固体粉末,其中可能含有Na2CO3、NaCl、Na2SO4、CuCl2、BaCl2、K2CO3和K2SO4中的一种或几种.现按下列步骤进行实验:
(1)将该粉末溶于水得无色溶液和白色沉淀;
(2)在滤出的沉淀中加入稀硝酸后,有部分沉淀溶解,同时产生无色气体;
(3)取滤液做焰色反应,火焰呈黄色,隔蓝色钴玻璃观察,未见紫色火焰。
由上述实验现象推断:混合物一定含有__________;一定不含有__________;不能肯定是否含有__________.
19.(5分)用洁净的铂丝蘸取某淡黄色粉末在无色火焰上燃烧时,火焰呈黄色。另取少量粉末放入试管中,加入少量水,有气泡产生,这种气体能使带火星的木条复燃。向该水溶液中滴入酚酞试液,溶液变红。推断这种淡黄色粉末是什么物质,写出有关反应的化学方程式。
①该物质的名称是________________________
②该物质与水反应的化学方程式为 __________________________________,反应中氧化剂是 _____________还原剂是___________
18.(7分)超氧化钾(KO2)常用于急救器中,它能吸收二氧化碳生成碳酸盐和氧气,这个反应的化学方程式为_________________________________________________。若用
17.(5分)(1)下列对焰色反应实验操作注意事项说明正确的是_______________
①K的火焰颜色要透过蓝色的钴玻璃观察
②先灼烧铂丝到与原来火焰颜色相同时,再蘸被检物质
③每次实验后要将铂丝用盐酸洗净,并在火焰上灼烧到没有颜色为止
④没有铂丝可以用光洁无锈的铁丝代替
(2)进行焰色反应检验K+时有以下步骤:①蘸取待测夜;②置于酒精灯焰上灼烧;③透过蓝色钴玻璃观察;④用稀盐酸洗净铂丝,其中正确的操作顺序是________________
16.(7分)碱金属原子的最外电子层都有______个电子,容易_______(填“失去”或“得到”)电子形成稳定的离子结构,表现化合价为______价;在Li、Na、K、Rb、Cs等五种元素中,随着核电荷数的增加,原子半径_____________,原子核对核外电子的引力____________,元素的原子失去电子的能力__________, 氧化物的水化物碱性最强的是_____________。
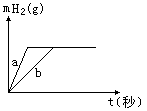 则下列说法中正确的是
( )
则下列说法中正确的是
( )
A.投入的Na、K一定等质量
B.投入的Na的质量小于K的质量
C.曲线a为Na,b为K
D.稀盐酸的量一定是不足量的
15.一定质量的钠、钾投入一定量的稀盐酸中,产生气体随时间变化的曲线如右图所示,
14.当质量为a g的某碱金属单质X与足量的氯气反应时,生 成氯化物质量为(a+35.5) g,若将等质量的碱金属单质X与氧气反应,生成化合物的质量可能为 ( )
A.(a+8)g B.(a+16)g C.(a+24)g D.(a+64)g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com