
C、电解的总反应式 N2+3H2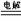 2NH3 D、电解的总反应式为 3H++N3-
2NH3 D、电解的总反应式为 3H++N3-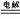 NH3
NH3
2. 1998年两位希腊化学家在《科学》杂志上发表论文,称他们在常压下把氢气和用氦气稀释的氮气分别通入一个加热到
A、阳极的反应式为 H2-2e - =2H+ B、阴极的反应式为 N2+6e - +6H+=2NH3
1.一种新型的燃料电池以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为:
A.负极反应为14H2O+7O2+28e-====28OH-
B.放电一段时间后,负极周围的pH升高
C.每消耗1 mol C2H6 ,则电路上转移的电子为14 mol
D.放电过程中KOH的物质的量浓度不变
3.某二元弱酸的酸式盐NaHA溶液,若PH<7,则溶液中各离子的浓度关系不正确的是
A.c (Na+) > c (HA―) > c (H+) > c (A2―) > c (OH―)
B.c (Na+) + c (H+)
= c (H―) +
C.c (H+) +
c (A2―) = c (OH―) + c (H
D.c (Na+)
== c (HA―) + c (H
² 电化学部分
常见题型:①原电池的基本原理;②原电池正负极的判断;③设计原电池,实现某一给定的反应;④原电池电极反应式的书写;⑤电极反应产物的计算
(C)c(HCN)- c(CN-)= c(OH-) (D)c(HCN)+ c(CN-)=0.1mol?L-1
2.将0.2 mol?L-1HCN溶液和0.1 mol?L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系中正确的是
(A)c(HCN)< c(CN-) (B)c(Na+)>c(CN-)
1.已知NaHSO3显酸性,NaHCO3溶液显碱性,现有浓度为0.1mol/L的NaHSO3和NaHCO3两种溶液,两种溶液中各粒子的浓度存在下列关系(R表示S或C),其中正确的一组是
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B.c(Na+)+c(H+)=c(HRO3-)+ c(RO32-)+c(OH-)
C.c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
D.c(Na+)=c(HRO3-)+(H2RO3)+
A.9~11之间;0.1 B.9~11之间;
² 盐类的水解及离子浓度大小的比较
①甲用蒸馏水稀释100倍后,溶液的pH将为a;②乙与等体积、浓度为0.2mol?L-1的HCl混合,在混合溶液中:n(NH4+)+n(H+)-n(OH―)=b mol 。a、b正确的答案组合是
2.常温下,有甲、乙两份体积均为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com