
能应用数学工具描述和分析处理物理问题.
2.理解交变电流的周期、频率以及它们之间的关系.知道我国生产和生活用电的周期(频率)的大小.
1.理解什么是交变电流的最大值和有效值,知道它们之间的关系.
0.150mol/0.300L = 0.500 mol•L-1
2.24L(标态) 13.8g 2.24L(标态) 10.0g
∵ 13.8g>11.9g>10.0g
∴ 得到的白色固体是 K2CO3和KHCO3的混合物。
设白色固体中 K2CO3 x mol,KHCO3 y mol,即
①CO2+2KOH=K2CO3+H2O ②CO2+KOH=KHCO3
x mol 2x mol x mol y mol y mol y mol
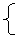 x mol+y mol=2.24L/22.4mol•L-1=0.100 mol (CO2)
x mol+y mol=2.24L/22.4mol•L-1=0.100 mol (CO2)
138g•mol-1 × x mol 100 g•mol-1 × y mol=11.9g (白色固体)
解此方程组,得
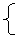 x=0.0500mol
(K2CO3)
x=0.0500mol
(K2CO3)
y=0.0500mol (KHCO3)
∴ 白色固体中 ,K2CO3 质量为 138g•mol-1 × 0.0500mol=6.90g
KHCO3质量为 100 g•mol-1 ×0.0500mol=5.00g
消耗 KOH 物质的量为
2x mol+y mol=2×0.0500mol+0.0500mol=0.150mol
∴所用 KOH 溶液物质的量浓度为
22.4L(标态) 138g 22.4L(标态) 100g
0.1mol钠原子就失去0.1mol电子,也就是0.1NA个电子。
D.不正确,重水分子(D2O)中含有10个中子,分子量为 20,18g重水所含中子
数为:10×18g/20g· mol-1=9mol。
答案:AC
[例6]在25℃、100kPa条件下,将15L O2通往10LCO和H2的混合气中,使其完全燃烧,干燥后,恢复至原来的温度和压强。
(1) 若剩余气体的体积是15L,则原CO和H2的混合气中:V(CO)=______L,V(H2)____L.
(2) 若剩余气体的体积为aL,则原CO和H2的混合气中V(CO): V(H2)=_____________。
(3) 若剩余气体的体积为aL,则a的取值范围是____________________.
解析:本题以H2 、CO燃烧反应为载体考查化学计算能力及由具体到一般的科研能力,审题关键:①2CO+ O=2CO2,2 H2+ O2=2 H2 O,反应物之间化学计量数比相同,推知完全燃烧,耗O2体积是H2 、CO混气体积1/2。②H2 、CO之间比值与O2剩余无关,一定剩余10L。③剩余气体混合物经干燥,一定不含H2 O,混合气成分为CO2、O2。
(用守恒法和极限法求解):由化学方程式2CO+ O=2CO2,2 H2+ O2=2 H2 O(液)知,10LH2 、CO混合气(无论其体积比如何)消耗的O2体积恒为5L。剩余的气体为O2(10L)和CO2的混合气,且由碳原子数目守恒知V(CO2)=V(CO)
(1)剩余气体15L,其中O2为10L,则V(CO2)=5L,V(H2)=10L-V(CO2)=5L,V(CO2)=V(CO)=5L。
(2)剩余气体为aL,则其中CO2为V(CO2)=aL-10L,V(CO)= V(CO2)=(a-10)L,V(H2)=10L-V(CO)=10L-(a-10)L=20L-Al,V(CO)/V(H2)=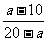
(3)因剩余气体中一定有10L O2,故a>10。设10L原气体全是CO,则最多有10L CO2,故a <20。A的取值范围是10<a<20
答案:(1)5L 5L (2)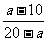 (3)10<a<20
(3)10<a<20
[例7]Cu、Cu2O和CuO组成的混合物,加入100Ml0.6mol/LHNO3溶液恰好使混合物溶解,同时收集到224mLNO气体(标准状况)。求:
(1) 写出Cu2O跟稀硝酸反应的离子方程式。
(2) 产物中硝酸铜的物质的量。
(3) 如混合物中含0.01moLCu,则其中Cu2O、CuO的物质的量分别为多少?
(4) 如混合物中Cu的物质的量为X,求其中Cu2O、CuO的物质的量及X的取值范围。
解析:本题为混合物的计算,若建立方程组求解,则解题过程较为繁琐。若抓住反应的始态和终态利用守恒关系进行求解,则可达到化繁为简的目的。
(1) 利用电子守恒进行配平。3Cu2O+14HNO3==6Cu(NO3)2 + 2NO↑+7H2O
(2) 利用N原子守恒。n(HNO3)== 0.06mol,n(NO)== 0.01mol,
则n(Cu(NO3)2)==(0.06-0.01)/2=0.025mol
(3) 本题混合物中虽含有Cu、Cu2O和CuO三种物质,但参加氧化还原反应的只有 Cu、Cu2O,所以:
转移电子总数:n(e-)= n(NO)×3==0.03mol
Cu提供电子数:0.01×2=0.02mol
Cu2O提供电子数:0.03-0.02=0.01mol n(Cu2O)=0.01/2=0.005mol
n(CuO)=0.0025-0.01-0.005×2=0.005mol
(4) 根据(3)解法可得n(Cu2O)=0.015-Xmol n(CuO)=X-0.005mol。根据电子守恒进行极端假设:若电子全由Cu提供则n(Cu)=0.015mol;若电子全由Cu2O提供则n(Cu2O)=0.015mol,则n(Cu2+)==0.03mol大于了0.025mol,说明n(Cu)不等于0,另根据n(CuO)=X-0.005mol要大于0可得n(Cu)>0.005mol。所以0.005mol < n(Cu)<0.015mol。
[例8]向300mL KOH溶液中缓慢通入一定量的CO2气体,充分反应后,在减压低温下蒸发溶液,得到白色固体。请回答下列问题:
(1)由于CO2通入量不同,所得到的白色固体的组成也不同,试推断有几种可能的组成,并分别列出。
(2)若通入CO2气体为2.24L(标准状况下),得到11.9g的白色团体。请通过计算确定此白色固体是由哪些物质组成的,其质量各为多少?所用的KOH溶液的物质的量浓度为多少
解析:(1)由于CO2和KOH反应时物质的量之比不同则产物不同,故可根据CO2和KOH反应时物质的量之比对产物进行讨论。由:①CO2+2KOH=K2CO3+H2O ②CO2+KOH=KHCO3可知n(CO2)/n(KOH)=1/2时产物为K2CO3,n(CO2)/n(KOH)=1时产物为KHCO3,所以n(CO2)/n(KOH)<1/2时,KOH 过量则产物为K2CO3+KOH ; 1/2< n(CO2)/n(KOH)<1时,对于①反应来说二氧化碳过量而对于②反应来说二氧化碳量不足,所以产物为K2CO3+KHCO3 ;n(CO2)/n(KOH)>1时,二氧化碳过量,则固体产物为KHCO3。 答案为:①K2CO3+KOH ②K2CO3 ③K2CO3+KHCO3 ④KHCO3
(2)由:①CO2+2KOH=K2CO3+H2O ②CO2+KOH=KHCO3
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com