
4. 锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。当生成1 mol硝酸锌时,被还原的硝酸的物质的量为
A.2 mol B.1 mol C.0.5 mol D.0.25 mol
[答案]D
[解析]:此题主要考查氧化还原反应的配平:Zn+HNO3(稀) Zn(NO3)2+NH4NO3+H2O,Zn:0→+2,化合价改变值为:(2-0)×1=2,N:+5→-3,化合价的改变值为:(5+3)×1=8,根据化合价升降总值相等得:在Zn(NO3)2前配4,NH4NO3前配1,然后根据反应前后各元素的原子个数相等,找出其他物质的系数。配平后的化学方程式为:4Zn+10HNO3(稀)===4Zn(NO3)2+NH4NO3+3H2O,当生成1mol的Zn(NO3)2时,被还原的HNO3为0.25mol21世纪教育网
Zn(NO3)2+NH4NO3+H2O,Zn:0→+2,化合价改变值为:(2-0)×1=2,N:+5→-3,化合价的改变值为:(5+3)×1=8,根据化合价升降总值相等得:在Zn(NO3)2前配4,NH4NO3前配1,然后根据反应前后各元素的原子个数相等,找出其他物质的系数。配平后的化学方程式为:4Zn+10HNO3(稀)===4Zn(NO3)2+NH4NO3+3H2O,当生成1mol的Zn(NO3)2时,被还原的HNO3为0.25mol21世纪教育网
[考点分析]氧化还原反应的计算
3. 物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是
A. 1:4 B.1:5 C. 2:3 D.2:5
[答案]A
[解析]设2molZn参与反应,因Zn无剩余,则最终生成了2molZn(NO3)2,显然含有4mol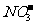 ,这部分是没有参与氧化还原反应的HNO3,根据得失电子守恒有:2×n(Zn)=n(HNO3)×4,则n(HNO3)=1mol,即有1molHNO3被还原。
,这部分是没有参与氧化还原反应的HNO3,根据得失电子守恒有:2×n(Zn)=n(HNO3)×4,则n(HNO3)=1mol,即有1molHNO3被还原。
[考点分析]氧化还原反应的计算
2. 常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
2Fe2++H2O2+2H+=2Fe3++2H2O,2Fe3++H2O2=2Fe2++O2↑+H+,下列说法正确的是( )
A.H2O2的氧化氢比Fe3+强,其还原性比Fe2+弱
B.在H2O2分解过程中,溶液的pH逐渐下降
C.在H2O2分解过程中, Fe2+和Fe3+的总量保持不变
D.H2O2生产过程要严格避免混入Fe2+
[答案]CD
[解析]由氧化还原反应的强弱律可知,氧化性是氧化剂大于氧化产物,还原性是还原剂大于还原产物,由方程一可知,氧化剂H2O2氧化性比氧化产物Fe3+强,由方程二可知,还原剂H2O2还原性比,原产物为Fe2+强,所以A错误;方程一和方程二相加,即H2O2分解生成H2O和O2,H2O2呈弱酸性,所以随着反应进行,pH升高,B错误;H2O2分解Fe3+或Fe2+作催化剂,所以总量不变,C正确;因为Fe2+可导致H2O2分解,所以H2O2生产过程要避免混入Fe2+,D正确21世纪教育网
[考点分析]氧化性和还原性强弱的比较考查。
1.下列类型的反应,一定发生电子转移的是 ( )
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
[答案]B
[解析]置换反应中肯定有单质参加,一定属于氧化还原反应,即一定有电子转移,C项正确。
[考点分析]四种基本反应类型与氧化还原反应的关系
4、 氧化还原反应方程式配平要依据原理:电子得失守恒和原子守恒。
[典例精析]
3、 关于氧化性还原性强弱比较要参照知识网络第三点。
2、 要明确解题的方法思路:理清概念抓实质,解题应用靠特征,即从氧化还原反应的实质电子转移,去分析理解有关概念,而在实际解题过程中,应从分析元素化合价有无变化这一氧化还原反应的特征入手。具体思路是:找变价、判类型、分升降、定其他。其中“找变价”是非常关键的一步,特别是反应物中含有同种元素的氧化还原反应,必须弄清它的变化情况21世纪教育网
1、 要理清知识线索,即价升高→失电子→还原剂→氧化反应→氧化产物(或价降低→得电子→氧化剂→还原反应→还原产物)。
18.(2010·沈阳二十中第一次月考)在进行校园文化建设时,不少学校在某些景点、设施上分别写上一句简短整齐有一定文采的标语,以对师生起到告诫、劝勉、激励、怡情等作用。请根据示例,在下列三个景物中,任选写两个。注意切合对象的特点,有意蕴,各不超过18个字。
示例:读书亭:入亭无杂念,开卷有书声。
(1)蓄水池:_____________________________________________________________
________________________________________________________________________
(2)大树:________________________________________________________________
________________________________________________________________________
(3)翠竹:_______________________________________________________________
________________________________________________________________________
[答案] 示例:蓄水池:只有先充实自己,才能服务别人。
大树:树大根深,本固枝荣。
翠竹:未出土时便有节,及凌云处也虚心。
17.(2010·哈师大附中第三次月考)请模仿下面这节诗的形式,表达你对“友情”或“理想”的感悟。
时间
时间是夹卷着冰雪的风暴,
会染白我们青春的额头;
时间是一道湍急的江流,
会淹没我们生命的行舟。
友情
______________________,
______________________;
______________________,
______________________。
理想
______________________,
______________________;
______________________,
______________________。
[答案] 友情是一缕和煦的春风,会拂去我们眼角的泪痕;友情是一抹明媚的阳光,会照亮我们孤寂的心房。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com