
13.有两种短周期元素X和Y,可组成化合物XY3,当Y的原子序数为m时,X的原子序数为 ① m-4 ② m+4 ③ m+8 ④ m-2 ⑤ m+6。其中正确的组合是
A.只有①②④ B.只有①②⑤ C.①②③⑤ D.①②③④⑤
12.据国外有关资料报道,在独居石(一种共生矿,化学成分为Ge, La, Nb,…的磷酸盐)中,查明尚有未命名的116、124、126号元素。试判断,116号元素应位于周期表中的
A.第6周期ⅣA族 B.第7周期ⅥA族 C.第7周期Ⅷ族 D.第8周期ⅥA族
10.短周期元素X、Y的原子序数相差2,下列有关叙述正确的是
A.X与Y不可能位于同一主族 B.X与Y一定位于同一周期
C.X与Y可能形成共价化合物XY D.X与Y不可能形成离子化合物XY
11(09海南卷).门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确。根据元素周期律,下列有关X性质的描述中错误的是
A.X单质不易与水反应
B.XO2可被碳或氢还原为X C . XCl4的沸点比SiCl4的高 D.XH4的稳定性比SiH4的高
C . XCl4的沸点比SiCl4的高 D.XH4的稳定性比SiH4的高
8.下列叙述正确的是
A.同一主族的元素,原子半径越大,其单质的熔点一定越高
B.同一周期元素的原子,半径越小越容易失去电子
C.同一主族元素的氢化物,相对分子质量越大,它的沸点一定越高
D.稀有气体元素的原子序数越大,其单质的沸点一定越高
 9(09四川).X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻。X的核电荷数是Y是核外电子数的一半,Y与M可形成化合物
9(09四川).X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻。X的核电荷数是Y是核外电子数的一半,Y与M可形成化合物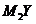 。下列说法正确的是
。下列说法正确的是
A.  还原性:X的氧化物>Y的氧化物>Z的氢化物
还原性:X的氧化物>Y的氧化物>Z的氢化物
B.  简单离子的半径:M的离子>Z的离子>Y的离子>X的离子
简单离子的半径:M的离子>Z的离子>Y的离子>X的离子
C.  YX
YX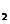 、M
、M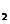 Y都是含有极性键的极性分子
Y都是含有极性键的极性分子
D.  Z元素的最高价氧化物的水化物的化学式为HZO4
Z元素的最高价氧化物的水化物的化学式为HZO4
5. R、W、X、Y、Z为原子序数依次递增的同一短周期的元素,下列说法一定正确的是(m、n均为正整数)
A.若R(OH)n为强碱,则W(OH)n+1也为强碱
B.若HnXOm为强酸,则Y是活泼非金属元素
C.若Y的最低化合价为-2,则Z的最高正化合价为+6
D.若X的最高正化合价为+5,则五种元素都是非金属元素
6(09山东卷). 元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是高考资
元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是高考资
A.同一元素不可能既表现金属性,又表现非金属性
 B.第三周期元素的最高正化合价等于它所处的主族序数
B.第三周期元素的最高正化合价等于它所处的主族序数
 C.短周期元素形成离子后,最外层电子都达到8电子稳定结构
C.短周期元素形成离子后,最外层电子都达到8电子稳定结构
 D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同
D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同
 7(09江苏卷). X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是
7(09江苏卷). X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是
 A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
 B.元素X不能与元素Y形成化合物
B.元素X不能与元素Y形成化合物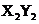
 C.元素Y、R分别与元素X形成的化合物的热稳定性:
C.元素Y、R分别与元素X形成的化合物的热稳定性: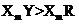
 D.元素W、R的最高价氧化物的水化物都是强酸
D.元素W、R的最高价氧化物的水化物都是强酸
4.某元素的电离能(电子伏特)如下表,此元素位于元素周期表的族数是
|
I1 |
I2 |
I3 |
I4 |
I5 |
I6 |
I7 |
|
14.5 |
29.6 |
47.4 |
77.5 |
97.9 |
551.9 |
666.8 |
A. ⅢA B.ⅣA C.ⅥA D.ⅤA E. ⅦA

 1(09全国Ⅱ卷). 某元素只存在两种天然同位素,且在自然界它们的含量相近,其相对原子质量为152.0,原子核外的电子数为63。下列叙述中错误的是
1(09全国Ⅱ卷). 某元素只存在两种天然同位素,且在自然界它们的含量相近,其相对原子质量为152.0,原子核外的电子数为63。下列叙述中错误的是

 A. 它是副族元素
B. 它是第六周期元素
A. 它是副族元素
B. 它是第六周期元素

 C. 它的原子核内有63个质子
D. 它的一种同位素的核内有89个中子
C. 它的原子核内有63个质子
D. 它的一种同位素的核内有89个中子
2.几种短周期元素的原子半径及主要化合价见下表:
|
元素符号 |
A |
B |
C |
D |
E |
|
原子半径(nm) |
0.160 |
0.080 |
X |
0.143 |
0.074 |
|
主要化合价 |
+2 |
+2 |
-2,+4,+6 |
+3 |
-2 |
则X可能的数值为
A.0.069 B.0.102 C.0.145 D.0.184
 3(09广东卷). 元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是
3(09广东卷). 元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是
 A.同周期元素中X的金属性最强
A.同周期元素中X的金属性最强
 B.原子半径X>Y,离子半径X+>Z2-
B.原子半径X>Y,离子半径X+>Z2-
 C.同族元素中Z的氢化物稳定性最高
C.同族元素中Z的氢化物稳定性最高
 D.同周期元素中Y的最高价含氧酸的酸性最强
D.同周期元素中Y的最高价含氧酸的酸性最强
5、元素金属性和非金属性强弱的判断方法
|
金 属 性 比 较 |
本质 |
原子越易失电子,金属性越强。 |
|
判 断 依 据 |
1.在金属活动顺序表中越靠前,金属性越强。 |
|
|
2.单质与水或非氧化性酸反应越剧烈,金属性越强。 |
||
|
3.单质还原性越强或离子氧化性越弱,金属性越强。 |
||
|
4.最高价氧化物对应水化物的碱性越强,金属性越强。 |
||
|
5.若xn++y=x+ym+
则y比x金属性强。 |
||
|
非 金 属 性 比 较 |
本质 |
原子越易得电子,非金属性越强。 |
|
判 断 方 法 |
1.与H2化合越易,气态氢化物越稳定,非金属性越强。 |
|
|
2.单质氧化性越强,阴离子还原性越弱,非金属性越强。 |
||
|
3.最高价氧化物的水化物酸性越强,非金属性越强。 |
||
|
4.An-+B=Bm-+A
则B比A非金属性强。 |
[典例分析]
例1(2010高考改编题)下列有关化学研究的正确说法是
A.酸性: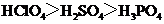 B.碱性:
B.碱性: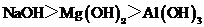
C.从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属递增的规律
D.关于SiO2晶体网状结构的叙述正确的是存在四面体结构单元,O处于中心,Si处于4个顶角
答案:A B
解析:本题改变后侧重考查元素周期律重要的基本概念,规律,晶体结构。A项正确,一般元素非金属性越强,对应最高价氧化物的水化物的酸性越强;B正确,一般元素金属性越强,对应最高价氧化物的水化物的碱性越强。C.在以酸性强弱作为判断元素非金属性非金属性强弱依据时,是以最高价氧化物对应水化物的酸性强弱为判断依据的,故C项错误。D.二氧化硅是原子晶体,结构为空间网状,存在硅氧四面体结构,硅处于中心,氧处于4个顶角所以D项错误
例2(09广东卷1) 我国稀土资源丰富。下列有关稀土元素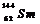 与
与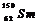 的说法正确的是
的说法正确的是
A. 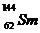 与
与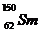 互为同位素
互为同位素
B. 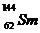 与
与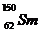 的质量数相同
的质量数相同
C. 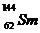 与
与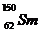 是同一种核素
是同一种核素
D. 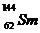 与
与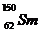 的核外电子数和中子数均为62
的核外电子数和中子数均为62
答案:A
解析: 由稀土元素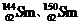 可知,该元素是含有相同质子不同中子的同种元素;其中
可知,该元素是含有相同质子不同中子的同种元素;其中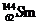 的质量数为144,中子数为82;
的质量数为144,中子数为82;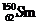 的质量数为150,中子数为88;故B、D项错;根据核素的定义“含有一定数目的质子和一定数目的中子”可知
的质量数为150,中子数为88;故B、D项错;根据核素的定义“含有一定数目的质子和一定数目的中子”可知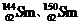 为两种核素,故C错。
为两种核素,故C错。
例3(2010广东理综卷,10)短周期金属元素甲~戊在元素周期表中的相对位置如右表所示,下面判断正确的是
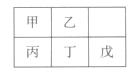 A.原子半径:
丙<丁<戊
B.金属性:甲>丙
A.原子半径:
丙<丁<戊
B.金属性:甲>丙
C.氢氧化物碱性:丙>丁>戊 D.最外层电子数:甲>乙
答案:C
解析:同周期元素原子半径是减小的,故A错;同主族元素金属性自上而下是增强的,故B错;同周期的元素的金属性越来越弱,故对应碱的碱性也是减弱的,C正确;同周期的最外层电子数越来越多,故D错。
例4(2010上海卷,20)几种短周期元素的原子半径及主要化合价如下表:
|
元素代号 |
X |
Y |
Z |
W |
|
原子半径/pm |
160 |
143 |
70 |
66 |
|
主要化合价 |
+2 |
+3 |
+3、-3、+5 |
-2 |
下列叙述正确的是
A.X、Y元素的金属性 X<Y
B.一定条件下,Z单质与W的常见单质直接生成2W2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
答案:D
答案:此题考查了物质结构与元素周期律知识。根据题给数据,X、Y的化合价不同,但原子半径相差较小,可知两者位于同一周期相邻主族,故金属性X>Y,A错;根据Z、W的原子半径相差不大,化合价不同,且W只有负价,则其可能是O,Z是N,两者的单质直接生成NO,B错;据此判断可知X是Mg,Y是Al;Y的最高价氧化物的水化物是氢氧化铝,其不溶于氨水,C错;一定条件下,氧气可以和氨气反应生成水和氮气,D对。
例5(09北京卷).W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7:17;X与W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反映为黄色。下列判断正确的是
A.金属性:Y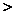 Z
B 氢化物的沸点:
Z
B 氢化物的沸点: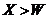
C.离子的还原性: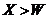 D 原子及离子半径:
D 原子及离子半径: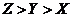
答案. B
[解析]本题考查物质结构和元素周期律。根据题设条件推知W为Cl、X为F、Y为Al、Z为Na。选项A,Al、Na 同周期,根据同周期元素递变规律,Na的金属性大于Al。选项B,HF分子间存在氢键,其沸点高于HCl。选项C,Cl―的还原性大于F―。选项D,Cl―的半径大于Na+、Al3+。
例6(2010山东卷,11)下列说法正确的是
A.形成离子键的阴阳离子间只存在静电吸引力
B.HF、HCL、HBr、HI的热稳定性和还原性从左到右依次减弱
C.第三周期非金属元素含氧酸的酸性从左到右依次增强
D.元素周期律是元素原子核外电子排布周期性变化的结果
答案:D
解析:离子键是阴阳离子通过静电作用形成的,静电作用包括静电吸引和静电排斥,故A错;因同驻足元素从上到下的非金属性减弱,故HF、HCL、HBr、HI的热稳定性依次减弱,但HF、HCL、HBr、HI的还原性依次增强,故B错;根据元素的非金属性越强,其对应的最高价汉阳算得酸性越强,C错‘因为没有指明是最高价含氧酸;元素周期律的根本原因是元素原子核外电子排布的周期性变化,D正确。
例7(2010浙江卷8). 有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期, Z、M同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中,正确的是
A. X、M两种元素只能形成X2M型化合物
B. 由于W、Z、M元素的氢气化物相对分子质量依次减小,所以其沸点依次降低
C. 元素Y、Z、W的单质晶体属于同种类型的晶体
D. 元素W和M的某些单质可作为水处理中的消毒剂
答案:D
解析:本题为元素周期律与周期表知识题。首先,运用周期表工具,结合周期规律,考虑位、构、性关系推断X、Y、Z、W、M分别是什么元素。在此基础上应用知识解决题给选项的问题。本题分析的要点或关键词是:短周期元素、同周期、同主族、相同的电子层结构、离子半径大小、单质晶体熔点硬度、半导体材料等。找到突破口:Y单质晶体熔点高硬度大、半导体材料,则Y是Si。根据X、Y、Z、W同周期,Z2- M2-知Z是S,M是O(Z、M同主族)。X+与M2-具有相同的电子层结构则X为Na。离子半径:Z2->W-,则W为Cl。整理一下:X\Y\Z\W\M分别是:Na\Si\S\Cl\O。
A、X、M两种元素能形成X2M和Na2O2两种化合物。B、W、Z、M元素的氢气化物分别为HCl\H2S\H2O,分子量减小,但由于水中存在氢键,沸点最高。C、Y、Z、W的单质分别为:Si\S\O2。分别属于原子晶体和分子晶体两种类型。D、W和M的单质Cl2\O3可作水处理剂。
例8(2010安徽卷,25)
X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
|
元素 |
相关信息 |
|
X |
X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
|
Y |
常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
|
Z |
Z和Y同周期,Z的电负性大于Y |
|
W |
W的一种核素的质量数为63,中子数为34 |
(1)Y位于元素周期表第 周期表 族,Y和Z的最高价氧化物对应的水化物的酸性较强的是 (写化学式)。
(2)XY2是一种常用的溶剂,XY2的分子中存在 个σ键。在H―Y、H―Z两种共价键中,键的极性较强的是 ,键长较长的是 。
(3)W的基态原子核外电子排布式是 。W2Y在空气中煅烧生成W2O的化学方程式是 。
(4)处理含XO、YO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质Y。
已知:
XO(g)+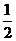 O2(g)=XO2(g)
O2(g)=XO2(g)  H=-283.0 kJ·mol-2
H=-283.0 kJ·mol-2
Y(g)+ O2(g)=YO2(g)
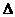 H=-296.0 kJ·mol-1
H=-296.0 kJ·mol-1
此反应的热化学方程式是 。
答案:(1)3 VIA HClO4
(2)2 H-Z H-Y
(3)[Ar]3d104s1 2Cu2S+3O2=2Cu2O+2SO2
(4)2CO(g)+SO2(g)=S(s)+2CO2 (g) △H=-270kJ/mol
解析:由表中可知,X为C Y为 S Z为 Cl W为Cu
例9(2010福建卷,23)
J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素。
(1)M的离子结构示意图为_____;元素T在周期表中位于第_____族。
(2)J和氢组成的化合物分子有6个原子,其结构简式为______。
(3)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为_____。
(4)L的最简单气态氢化物甲的水溶液显碱性。
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,所发生反应的产物不污染环境,其化学方程式为______。
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是_______(选填序号)。
|
选项 |
a |
b |
c |
d |
|
x |
温度 |
温度 |
加入H2的物质的量 |
加入甲的物质的量 |
|
y |
甲的物质的量 |
平衡常数K |
甲的转化率 |
生成物物质的量总和 |
(5)由J、R形成的液态化合物JR2 0.2mol在O2中完全燃烧,生成两种气态氧化物,298K时放出热量215kJ。 该反应的热化学方程式为________。
解析:
(1) J元素最低负化合价的绝对值与其原子最外层电子数相等,可以判断J元素为碳元素;M是地壳中含量最多的金属元素为铝元素;根据J、R在周期表中的相对位置可以判断R为硫元
素,则T为氯元素,处于第三周期第七主族
(2)J和氢组成含有6个原子的分子为乙烯,其结构简式为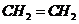
(3)M和T形成的化合物为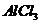 ,与水反应
,与水反应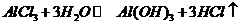 ,其中氯化氢气体呈雾状
,其中氯化氢气体呈雾状
(4)①氨水与双氧水发生氧化还原反应: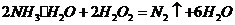
生成无污染的氮气;
②甲在固体体积的密闭容器中发生分解反应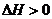 ,
,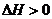 表明正反应为吸热反应,升高温度,平衡朝着正方向移动,甲物质的量减少;加入
表明正反应为吸热反应,升高温度,平衡朝着正方向移动,甲物质的量减少;加入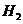 的物质的量即增加生成物的浓度,平衡朝逆方向移动,甲的转化率减小
的物质的量即增加生成物的浓度,平衡朝逆方向移动,甲的转化率减小
(5)JR2为CS2,燃烧生成二氧化碳和二氧化硫,依题意可以很快的写出反应的热化学方程式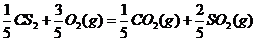
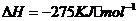
答案:(1) 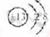 ; ⅦA
; ⅦA
(2)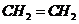
(3)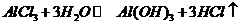 ,
,
(4)①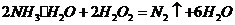
②a和c;a或c
(5)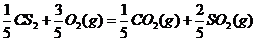
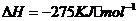
 例10(09安徽卷25)
例10(09安徽卷25)
 W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数一次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。
W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数一次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。
 (1)W位于元素周期表第_________周期第_________族。W的气态氢化物稳定性比
(1)W位于元素周期表第_________周期第_________族。W的气态氢化物稳定性比
 H2O(g)__________(填“强”或“弱”)。
H2O(g)__________(填“强”或“弱”)。
 (2)Y的基态原子核
外电子排布式是________,Y的第一电离能比X的__________(填“大”或“小”)。
(2)Y的基态原子核
外电子排布式是________,Y的第一电离能比X的__________(填“大”或“小”)。
 (3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是
 _________________________________________________________________________。
_________________________________________________________________________。

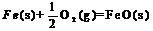
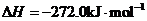

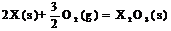
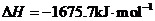
 X的单质和FeO反应的热化学方程式是_________________________________________。
X的单质和FeO反应的热化学方程式是_________________________________________。
 答案:(1)二 VA 弱
答案:(1)二 VA 弱
 (2)1s22s22p63s23p4 大
(2)1s22s22p63s23p4 大
 (3)Cu + 2H2SO4(浓)
(3)Cu + 2H2SO4(浓)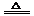 CuSO4 + SO2↑+ 2H2O
CuSO4 + SO2↑+ 2H2O
 (4)3FeO(s) + 2Al(s)
(4)3FeO(s) + 2Al(s)  Al2O3(s) + 3Fe(s)
H=-859.7KJ/mol
Al2O3(s) + 3Fe(s)
H=-859.7KJ/mol
 解析:首先推出题中几种元素,W、Y的氧化物是导致酸雨的主要物质,在结合原子序数的大小可知,W是氮元素,Y是硫元素,X的基态原子核外有7个原子轨道填充了电子,根据基态原子核外电子所遵循的原则,可以写出电子排布式为:1s22s22p63s23p1,X为铝元素,Z能够形成红色的Z2O和黑色的ZO两种氧化物,推知Z为铜元素,两种氧化物分别为Cu2O和CuO。
解析:首先推出题中几种元素,W、Y的氧化物是导致酸雨的主要物质,在结合原子序数的大小可知,W是氮元素,Y是硫元素,X的基态原子核外有7个原子轨道填充了电子,根据基态原子核外电子所遵循的原则,可以写出电子排布式为:1s22s22p63s23p1,X为铝元素,Z能够形成红色的Z2O和黑色的ZO两种氧化物,推知Z为铜元素,两种氧化物分别为Cu2O和CuO。
[随堂检测]
4、简单微粒半径的比较方法
|
原 子 半 径 |
1.电子层数相同时,随原子序数递增,原子半径减小 例:rNa>rMg>rAl>rSi>rp>rs>rCl 2.最外层电子数相同时,随电子层数递增原子半径增大。 例:rLi<rNa<rk<rRb<rCs |
|
离 子 半 径 |
1.同种元素的离子半径:阴离子大于原子,原子大于阳离子,低价阳离子大于高价阳离子.例:rCl->rCl,rFe>rFe2+>rFe3+ 1. 电子层结构相同的离子,核电荷数越大,半径越小. 例:rO2->rF->rNa+>rMg2+>rAl3+ 2. 带相同电荷的离子,电子层越多,半径越大. 例:rLi+<rNa+<rK+<rRb+<rcs+;rO2-<rs2-<rse2-<rTe2- 3. 带电荷、电子层均不同的离子可选一种离子参照比较。 例:比较rk+与rMg2+可选rNa+为参照可知rk+>rNa+>rMg2+ |
3、同周期同主族元素递变规律
|
|
|
同周期(左→右) |
同主族(上→下) |
|
原子结构 |
核电荷数 |
逐渐增大 |
增大 |
|
电子层数 |
相同 |
增多 |
|
|
原子半径 |
逐渐减小 |
逐渐增大 |
|
|
|
化合价 |
最高正价由+1→+7负价数=8-族序数 |
最高正价和负价数均相同,最高正价数=族序数 |
|
元素的金属性和非金属性 |
金属性逐渐减弱,非金属性逐渐增强。 |
金属性逐渐增强,非金属性逐渐减弱。 |
|
|
单质的氧化性和还原性 |
氧化性逐渐增强,还原性逐渐减弱。 |
氧化性逐渐减弱,还原性逐渐增强。 |
|
|
最高价氧化物的水化物的酸碱性 |
酸性逐渐增强,碱性逐渐减弱。 |
酸性逐渐减弱,碱性逐渐增强。 |
|
|
气态氢化物的稳定性、还原性,水溶液的酸性。 |
稳定性逐渐增强,还原性逐渐减弱,酸性逐渐增强。 |
稳定性逐渐减弱,还原性逐渐增强,酸性逐渐减弱。 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com