
22.(15分)X、Y、Z、W四种物质有如下相互转化关系(其中X、W单质,Y、Z为化合物,未列出反应条件)。
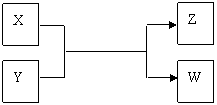
Ⅰ.若Z是生活中常用的调味品,W遇淀粉溶液变蓝,则:
(1)常温下,X的颜色是 。
(2)工业上Z有多种用途,用化学方程式表示Z的一种用途 。
(3)生活中所用的Z加入了碘酸钾,过量X与Y溶液反应时可以得到一种碘酸盐,此反应的离子方程式是 。
Ⅱ.下面是某化学课外活动小组研究浓H2SO4的氧化性的结论并进行了实验验证:
①一般认为H2SO4浓度大于60%,就具有一定的强氧化性,越浓氧化性越强,60%以下的H2SO4主要体现的是酸性,基本上不体现强氧化性。
②温度也影响氧化性,如铜放于冷的浓H2SO4中反应不明显,如果加热就可以观察到明显现象。
 ③98%的浓H2SO4物质的量浓度为18.4
mol/L,密度为1.84 g·cm-3,根据以上信息回答:
③98%的浓H2SO4物质的量浓度为18.4
mol/L,密度为1.84 g·cm-3,根据以上信息回答:
(1)如图装置,同学甲先向带支管的试管中放入铜粉和3 mL水,然后从分液漏斗中加98%的浓H2SO4 0.5 mL,加热至沸腾,该试管中液体没有明显变化,试用数据解释
原因 。
(2)乙同学利用所示装置直接从分液漏斗中再加浓H2SO4 10 mL与铜片反应。在左边试管中所观察到与甲不同的现象除了有黑色物质出现外,还有
① ,
原因是 。
② ,
原因是 。
21.(11分)用Cl2消毒会使饮用水中的有机物发生氯化,生成有机氯化合物,于人体有害。世界环保联盟即将全面禁止用氯气对饮用水消毒。建议推广采用广谱性高效消毒剂ClO2气体。
(1)目前,欧洲一些国家用NaClO3氧化浓盐酸制取ClO2,同时有Cl2生成,且Cl2体积为ClO2的一半,该反应的化学方程式是: 。
(2)我国最近研究成功用氯气氧化亚氯酸钠(NaClO2,N2保护下)制ClO2,其反应的化学方程式为: ,
这一反应的优点是: 。
(3)在H2SO4存在的条件下,用Na2SO3还原NaClO3也可制ClO2,其反应的化学方程式为:
。
26.(共14分)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态。分析图(本题最下方)中信息,回答下列问题:
(1)图一是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: 。在反应体系中加入催化剂,E1和E2的变化是:E1_________,E2________(填“增大”、“减小”或“不变”),对反应热是否有影响?_______________,原因是_________
。
(2)图二是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程与能量关系图(图中的△H表示生成1mol产物的数据)。根据图二回答下列问题:
① P(s)和Cl2(g)反应生成PCl3(g)的热化学方程式 。
PCl5(g)分解成PCl3(g)和Cl2(g)的热化学方程式 。
② P(s)和Cl2(g)分两步反应生成1molPCl5(g)的△H1与P(s)和Cl2(g)一步反应生成1molPCl5(g)的△H2关系是:△H2______ △H1(填“大于”、“小于”或“等于”),原因是 。






25. (共10分)短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(共10分)短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(1)元素的非金属性为(原子的得电子能力):Q______W(填“强于”或“弱于”)。
可证明此结论的实验事实是 。
(2)原子序数比R多1的元素是一种氢化物能分解为它的另一种氢化物,
此分解反应的化学方程式是________ __;
若增大化学反应速率,可向溶液中加催化剂 或 。
(3)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的 =________(注:题中所设单质均为最稳定单质)
=________(注:题中所设单质均为最稳定单质)
24.(共8分)“碘钟”实验中,3I-+S2O82-=I3-+2SO42-的反应速率可以用I3-与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,得到的数据如下表:
|
实验编号 |
① |
② |
③ |
④ |
⑤ |
|
c(I-)/mol·L- |
0.040 |
0.080 |
0.080 |
0.160 |
0.120 |
|
c(SO42-)/mol·L- |
0.040 |
0.040 |
0.080 |
0.020 |
0.040 |
|
t
/s |
88.0 |
44.0 |
22.0 |
44.0 |
t2 |
回答下列问题:
(1)该实验的目的是 。
(2)显色时间t2= 。
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为 (填字母)
A <22.0s B 22.0-44.0s C >44.0s D 数据不足,无法判断
(4)通过分析比较上表数据,得到的结论是 。
23.(共9分)某研究小组将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50 mL)。回答下列问题:

(1)研究小组做该实验时环境温度 (填“高于”、“低于”或“等于”)22 ℃,判断的依据是 。
(2)由题干及图形可知,V1 / V2= 时,酸碱恰好完全中和,此反应所用NaOH溶液的浓度应为 mol/L。
(3)若通过实验测定及有关计算知此反应共放出Q KJ的热量,请写出此反应的热化学方程式:
22. (5分)一定温度下,在体积恒定的密闭容器中,加入A(s)和B(g),进行如下可逆反应:A(s)+2B(g) C(g)+D(g)
(5分)一定温度下,在体积恒定的密闭容器中,加入A(s)和B(g),进行如下可逆反应:A(s)+2B(g) C(g)+D(g)
(1)当下列物理量 (填序号)不发生变化时,能表明该反应已达到平衡状态。
①容器内气体压强 ②混合气的总质量 ③A的质量
④C(g)和D(g)的物质的量之比为1∶1。
(2)当上述反应达到化学平衡后,继续通入一定量的B(g),V(正)将 (填“增大”、“减小”或“不变”),平衡向着 方向移动,达到新平衡后,A(s)质量将 (填“增大”、“减小”或“不变”)。
21.(4分) 火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出256.652KJ的热量。反应的热化学方程式为 。
20.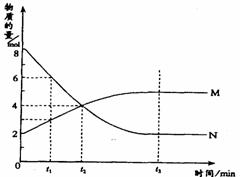 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是
A.反应的化学方程式为:2M N
N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
太 原 五 中
2010-2011年学年度第一学期月考(9月)
高二化学(理)答卷纸
将选择题答案填在下面的表格中
第二卷 非选择题(共50分)
19. 恒温恒容条件下,发生化学反应H2(g)+I2(g) 2HI(g),下列选项中不能作为达平衡标志的是
恒温恒容条件下,发生化学反应H2(g)+I2(g) 2HI(g),下列选项中不能作为达平衡标志的是
A.混合气体颜色不再变化
B.单位时间内生成nmol氢气的同时生成nmol碘蒸气
C.若该反应在隔热密闭体积恒定的容器中进行反应,体系的温度不再变化
D.2V正(H2)= V逆(HI)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com