
| A. | 将CO2通入CaCl2溶液中,有白色沉淀生成 | |
| B. | 金刚石、石墨和C60都是碳元素的单质 | |
| C. | 在一定条件下CO2能够转变成CO | |
| D. | 将CO2通入紫色石蕊溶液中,可看到溶液变红 |
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:实验探究题
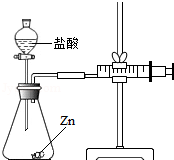 化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.| 实验编号 | 选用金属(均取2g) | 盐酸质量分数(均取50mL) | 每分钟产生氢气的体积/mL | |||||
| 1分钟 | 1-2分钟 | 2-3分钟 | 3-4分钟 | 4-5分钟 | 前5分钟共收集气体 | |||
| Ⅰ | 锌片 | 15% | 2.9 | 16.9 | 11.0 | 9.2 | 7.6 | 48.5 |
| Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题


查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 一氧化碳不仅可作燃料,还能作化工原料:
一氧化碳不仅可作燃料,还能作化工原料:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 实验操作 | 现象 | 结论 | |
| A | 用拇指堵住收集了甲烷的试管口,靠近火焰,移开拇指点火 | 发出轻微爆鸣声 | 试管中气体为纯净物 |
| B | 往装有某溶液的试管中滴加稀硫酸 | 产生白色沉淀 | 一定含有Ba2+ |
| C | 把燃着的木条插入某瓶无色气体中 | 木条熄灭 | 该瓶中气体不一定是二氧化碳 |
| D | 在燃烧匙里放少量硫,加热,直到发生燃烧,然后把它伸进充满氧气的集气瓶中 | 硫在空气中燃烧发出淡蓝色火焰,而在氧气中燃烧更旺,发出蓝紫色火焰 | 氧气的浓度越小,燃烧越 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 某学习小组在如图所示的化学药品柜中发现一瓶标签模糊不清的无色溶液,已知这瓶溶液是以下5瓶溶液中的一种:HNO3溶液、Al(NO3)3溶液、Ba(NO3)2溶液、Fe(NO3)2溶液、AgNO3溶液.
某学习小组在如图所示的化学药品柜中发现一瓶标签模糊不清的无色溶液,已知这瓶溶液是以下5瓶溶液中的一种:HNO3溶液、Al(NO3)3溶液、Ba(NO3)2溶液、Fe(NO3)2溶液、AgNO3溶液.| 实验操作 | 预期现象与结论 |
| 1 | 实验现象:溶液变浑浊; 实验结论:是硝酸银溶液 |
| 2 | 实验现象:产生白色沉淀; 实验结论:是硝酸钡溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com