
 2KCl+3O2↑;收集到的氧气不纯,可能的原因是装置气密性不好,使气体中含有空气;或没等导管口放出连续而均匀的气泡就收集,使收集到的氧气中混有空气;或用排水法收集氧气时,事先集气瓶中没注满水,留有气泡,使收集的气体中含有空气等.
2KCl+3O2↑;收集到的氧气不纯,可能的原因是装置气密性不好,使气体中含有空气;或没等导管口放出连续而均匀的气泡就收集,使收集到的氧气中混有空气;或用排水法收集氧气时,事先集气瓶中没注满水,留有气泡,使收集的气体中含有空气等. 2KCl+3O2↑;有气泡逸出就收集(其他合理答案均可);
2KCl+3O2↑;有气泡逸出就收集(其他合理答案均可);

科目:初中化学 来源: 题型:阅读理解
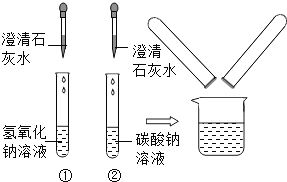 (2012?闸北区二模)鉴别碳酸钠溶液和氢氧化钠溶液的实验结束后,小红同学将①、②两支试管中的废液倒入同一个干净的烧杯中,看到废液浑浊,就对废液进行了过滤,小红等几位同学对滤液的成分又进行了探究.
(2012?闸北区二模)鉴别碳酸钠溶液和氢氧化钠溶液的实验结束后,小红同学将①、②两支试管中的废液倒入同一个干净的烧杯中,看到废液浑浊,就对废液进行了过滤,小红等几位同学对滤液的成分又进行了探究.| 实验步骤 | 实验现象 | 实验结论 |
| 取样于试管中, 通入二氧化碳 通入二氧化碳 |
出现浑浊 出现浑浊 |
你的猜想正确 |
| 实验步骤 | 实验现象 | 实验结论 |
| 取样于试管中,滴入几滴稀盐酸 | 没有气泡产生 | 自己的猜想不成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:
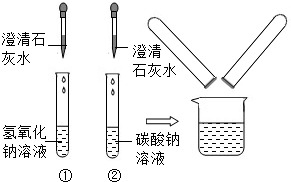
| 实验步骤 | 实验现象 | 实验结论 |
| 取样于试管中, 通入二氧化碳气体 通入二氧化碳气体 |
试管中出现白色浑浊 试管中出现白色浑浊 |
你的猜想正确 |
查看答案和解析>>
科目:初中化学 来源: 题型:
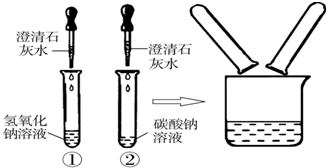
| 实验步骤 | 实验现象 | 实验结论 |
| 取样于试管中, 通入二氧化碳气体 通入二氧化碳气体 |
试管中出现白色浑浊 试管中出现白色浑浊 |
你的猜想正确 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com