
【题目】碳酸锂作为锂的基础锂盐,广泛用于玻璃制造和陶瓷生成过程中的添加剂,也是制备锂电池的重要原料。碳酸锂在热水中的溶解度很小,工业上以锂辉石精矿(主要成分是Li2O,含有Al2O3、SiO2 等杂质)为原料制取碳酸锂,其“硫酸法”生产工艺流程如下图所示。请回答问题:
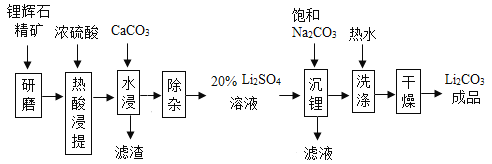
(1)锂辉石热酸浸提前要进行“研磨”,其目的是_____。
(2)“水浸”中加入CaCO3的作用之一是为了调节pH=5,让溶液中的Ai3+变成Al(OH)3沉淀出来,要确定溶液的pH为5,可以使用pH试纸来测定。其操作方法是_____。
(3)“沉锂 ”中要加入的Na2CO3溶液是饱和溶液,其作用是_____,反应化学方程式为_____。
(4)“洗涤”中使用热水,原因是_____。证明Li2CO3洗涤干净的方法是_____。(写操作,现象和结论)
【答案】为了增大矿物与酸的接触面积,加快热酸浸提的速率 将一小片pH试纸放在白瓷板上,用干燥玻璃棒蘸取溶液滴到pH试纸上,再与标准比色卡比对,读出pH 为了提高反应物的浓度,有利于Li2SO4转化为Li2CO3 Li2SO4+Na2CO3═Na2SO4+Li2CO3↓ 碳酸锂在热水中溶解度很小,避免了洗涤过程中碳酸锂的损耗 取少量洗涤后的溶液于试管中,滴入足量稀盐酸,充分反应后滴入氯化钡溶液,若无明显现象,则已洗涤干净
【解析】
(1)锂辉石热酸浸提前要进行“研磨”,其目的是为了增大矿物与酸的接触面积,加快热酸浸提的速率;
(2)正确保用pH试纸的方法是:将一小片pH试纸放在白瓷板上,用干燥玻璃棒蘸取溶液滴到pH试纸上,再与标准比色卡比对,读出pH;
(3)“沉锂”中加入的Na2CO3溶液是饱和溶液是为了提高反应物的浓度,有利于Li2SO4转化为Li2CO3;反应的化学方程式为:Li2SO4+Na2CO3═Na2SO4+Li2CO3↓;
(4)碳酸锂在热水中溶解度很小,避免了洗涤过程中碳酸锂的损耗;由于硫酸锂能与氯化钡反应生成了硫酸钡沉淀,和氯化锂,所以证明洗涤干净的方法是:取少量洗涤后的溶液于试管中,滴入足量稀盐酸,充分反应后滴入氯化钡溶液,若无明显现象,则已洗涤干净。


科目:初中化学 来源: 题型:
【题目】用集气瓶可完成多种实验.对下列实验示意图的分析正确的是
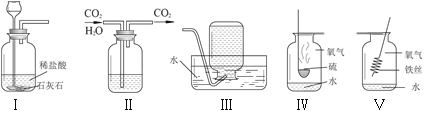
A.连接Ⅰ、Ⅲ装置,可以制取二氧化碳
B.Ⅱ中的液体一定可以做干燥剂
C.Ⅳ、Ⅴ中水的作用相同
D.将Ⅰ中药品改为双氧水和二氧化锰,依次连接Ⅰ、Ⅱ、Ⅲ装置,可以得到干燥的氧气
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某学校饮水处将自来水净化为饮用水,其中处理步骤如图所示:
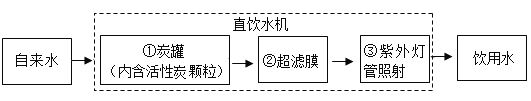
(1)检验上述自来水是硬水还是软水,常用________来区分,生活中可以通过______降低水的硬度。
(2)步骤①对应的作用是________(填字母,下同);②对应的作用是________; ③对应的作用________。
A杀菌消毒 B吸附色素、异味等 C过滤 D蒸储
(3)节约用水和合理开发利用水资源是每个公民应尽的责任和义务,请你说出一种生活中节约用水的具体做法_________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】联合国大会2017年12月20日将2019年指定为“化学元素周期表国际年”,纪念独俄国科学家门捷列夫编制化学元素周期表150周年。下表是元素周期表中1号-18号原子结构示意图,回答以下问题。
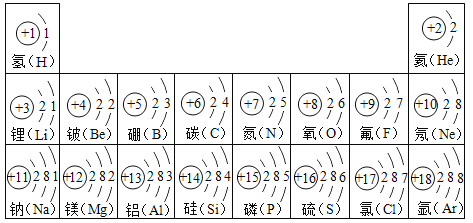
(1)氧元素与硫元素化学性质相似的原因是______________。
(2)铝离子的结构示意图为________________。
(3)铝制品材料表面常有一层致密的氧化膜,阻止内部的铝进一步氧化,故铝制品经久耐用。用化学方程式表示该氧化膜的形成:_______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】KNO3、NaNO3、NaC1的溶解度曲线如图所示,下列说法正确的是
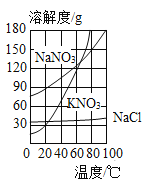
A.20℃时,KNO3的溶解度最大
B.0℃时,100 g NaNO3饱和溶液中含73 g NaNO3
C.从NaCl溶液中获取NaCl晶体时,必须采用冷却热饱和溶液的方法。
D.分别将20℃的KNO3、NaNO3饱和溶液加热至80℃时,NaNO3 溶液溶质的质量分数大于KNO3溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水和溶液在生产、生活中起着十分重要的作用。
(1)如图所示,三个实验均和水有关。
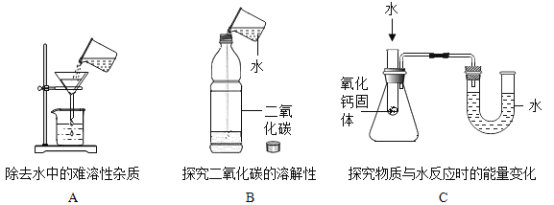
①请指出实验 A 中过滤操作的两处错误:_____________、____________。
②实验 B 能说明 CO2 可溶于水,并写出发生反应的化学方程式为_____。
③实验 C,滴加水后能看到 U 形管中_____(填“左边”或“右边”)液面升高。
(2)下面是利用海水提取粗盐的过程。
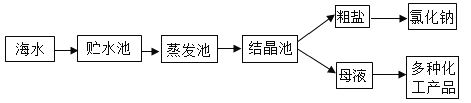
下列分析正确的是(填序号)_____。
A海水进入贮水池,海水的成分基本不变
B在蒸发池中,海水中氯化钠的质量逐渐增加
C在蒸发池中,海水中水的质量逐渐减少
D析出晶体后的母液是氯化钠的不饱和溶液
(3)农业上常用溶质质量分数为 16%的氯化钠溶液来选种,良种会下沉,次种会漂浮。
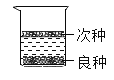
①室温下氯化钠的溶解度约为 36g。上述选种用的氯化钠溶液是_____(填“饱和”或 “不饱和”)溶液。
②若用溶质质量分数为 24%的氯化钠溶液和蒸馏水来配制 300g 溶质质量分数为 16%的氯 化钠溶液,则需要蒸馏水的质量为_____。
(4)如图是甲乙两种物质的溶解度曲线(不含结晶水)请回答下列问题:
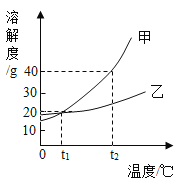
①下列说法一定正确的是______________。
A甲的溶解度比乙的溶解度大
Bt1℃时,甲、乙的饱和溶液的溶质的质量分数相等
C常温下,乙易溶于水
D从 t2℃降至 t1℃,甲、乙溶液中均有晶体析出
②甲中混有少量的乙,要提纯甲,实验步骤:加水溶解,蒸发浓 缩,___________,然后过滤。
查看答案和解析>>
科目:初中化学 来源: 题型:
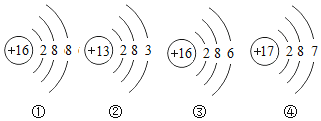
【题目】镓是一种奇妙的金属,放在手心马上熔化就如荷叶上的水珠流来流去,请回答:
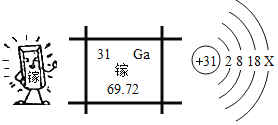
(1)镓可以做高温温度计,用微粒的观点解释温度计示数改变的原因是____________。
(2)镓元素与氧元素形成化合物的化学式为______________。
(3)上面是四种粒子的结构示意图,其中与镓同属于金属原子的是__________(填序号)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列实验设计能够达到实验目的的是
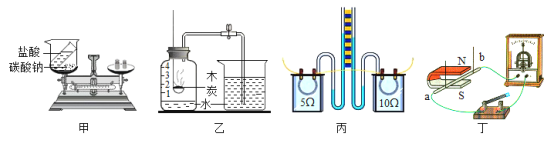
A.甲图验证质量守恒定律
B.乙图测空气中氧气含量
C.丙图探究物体的吸热能力与哪些因素有关
D.丁图探究导体在磁场中产生电流的条件
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下列实验装置回答问题。
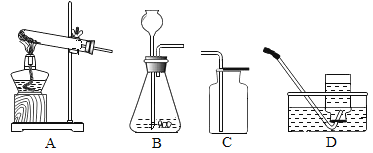
(1)用A制氧气的化学方程式为_____,大试管口略朝下倾斜的目的是_____。用D收集氧气的依据是_____。
(2)用B制取氧气的化学方程式为_____,该装置也可用于实验室制_____。理由是_____;用C收集氧气验满的方法是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com