
| A. | HCl CuCl2 NaNO3 Na2SO4 | B. | BaCl2 Na2CO3 HCl (NH4)2CO3 | ||
| C. | FeCl3 HCl NaCl NaOH | D. | Na2CO3 Na2SO4 HCl H2SO4 |
分析 不选用其他试剂鉴别,首先需要考虑物质的水溶液的颜色,然后物质间两两混合,根据实验现象的差异进行判断即可.
解答 解:A、观察颜色,蓝色的为氯化铜溶液,将氯化铜溶液与其他三种溶液混合,都不反应,无现象,无法鉴别,故A错误;
B、将溶液两两混合,有一种溶液能与其余两种溶液产生气体,则该溶液是盐酸,与盐酸混合无现象的是氯化钡,但是碳酸钠和碳酸铵无法鉴别,故B错误;
C、观察颜色,黄色的是氯化铁溶液;将氯化铁溶液与其余三种溶液混合,产生红褐色沉淀的是氢氧化钠,向产生的沉淀中滴加剩余溶液中的一种,若沉淀溶解,则加入的是盐酸,剩余的是氯化钠,现象不同,可以鉴别,故C正确;
D、将溶液两两混合,有一种溶液能与其余两种溶液产生气泡,则该物质是碳酸钠,与其混合没有现象的是硫酸钠,但是无法鉴别盐酸和硫酸,故D错误;
故选C.
点评 本题考查了常见物质的鉴别,完成此题,可以依据物质的性质差异进行.


科目:初中化学 来源: 题型:解答题
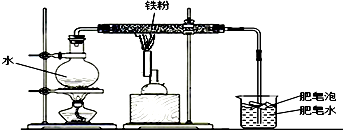 小明记得在学习金属活动性顺序的应用时,老师曾说过一般不会用K、Ca、Na等活泼金属和盐溶液进行置换反应,因为这些金属能直接和水发生反应生成对应的碱和氢气.小明查阅资料如下:
小明记得在学习金属活动性顺序的应用时,老师曾说过一般不会用K、Ca、Na等活泼金属和盐溶液进行置换反应,因为这些金属能直接和水发生反应生成对应的碱和氢气.小明查阅资料如下:| 实验方案 | 实验现象 | |
| 甲 | 将磁铁靠近黑色粉末 | 黑色粉末可被磁铁全部吸引 |
| 乙 | 取少量黑色粉末加入稀盐酸中 | 有气泡 |
| 实验方案 | 实验现象 | 结论或化学方程式 |
| 1、取实验后的黑色粉末,加入足量的A溶液,搅拌使反应充分. | 黑色物质表面有红色物质,溶液颜色出现较浅的绿色,烧杯底部仍有较多黑色物质 | Fe+CuSO4=FeSO4+Cu |
| 2、过滤、洗涤、干燥,再用磁铁吸引 | 黑色物质可被磁铁全部吸引,留下红色固体 | 被磁铁吸引的物质是铁 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. |  称16.5g氢氧化钠 | B. |  稀释浓硫酸 | ||
| C. |  滴管的使用 | D. | 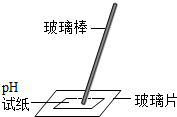 测溶液的pH值 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
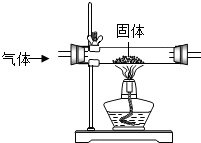 用图中的装置可进行气体和固体的反应.
用图中的装置可进行气体和固体的反应.| 组别 | 固体 | 气体 | 装置内发生反应的化学方程式 |
| 1 | |||
| 2 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 序号 | 物 质 | 选用试剂 |
| A | CaCl2溶液(盐酸) | 过量的Na2CO3溶液 |
| B | NaOH溶液(Na2CO3溶液) | 适量的Ca(OH)2溶液 |
| C | CuO(Cu) | 足量的稀H2SO4 |
| D | KCl溶液(K2SO4溶液) | 适量的Ba(NO3)2溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 名称 | 食用纯碱 | 食用小苏打 |
| 主要成分 | Na2CO3 | NaHCO3 |
| 酸碱性 | 水溶液显碱性 | 水溶液显碱性 |
| 热稳定性 | 受热不分解 | 270℃时完全分解为碳酸钠、二氧化碳、水 |
| 称量项目 | 称量时间 | 电子天平试样足量稀盐酸 质量/g |
| 试样 | 11.0 | |
| 装置+稀盐酸 | 160.0 | |
| 装置+稀盐酸+试样 | 反应开始后20s | 167.0 |
| 装置+稀盐酸+试样 | 反应开始后30s | 166.6 |
| 装置+稀盐酸+试样 | 反应开始后90s | 166.6 |
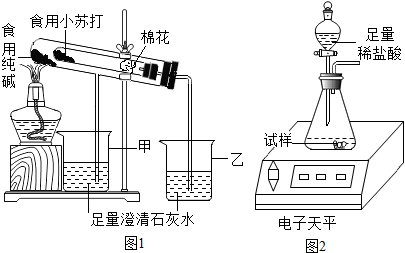
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 实验步骤 | 实验现象 | 实验结论 |
| ①取无色滤液少许于试管中,滴加过量的BaCl2溶液 | 产生白色沉淀 | 猜想Ⅱ不成立 |
| ②在①反应后的试管中滴加无色酚酞溶液 | 溶液变为红色 | 猜想Ⅲ成立 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com