
【题目】KNO3与NaCl的溶解度曲线如图所示。下列说法正确的是
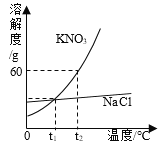
A. t1℃时,等质量的KNO3和NaCl饱和溶液中溶质质量一定相等
B. t2℃时,100 g KNO3的饱和溶液中含KNO3 60 g
C. KNO3溶液中混有少量NaCl,可采用蒸发结晶的方法提纯KNO3
D. 其它条件不变,升高温度可使KNO3的饱和溶液变成不饱和溶液
科目:初中化学 来源: 题型:
【题目】超细碳酸钙可用于生产钙片、牙膏等产品。利用碳化法生产超细碳酸钙的主要流程示意如图:
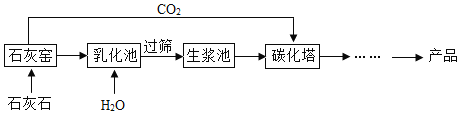
(1)石灰窑中发生的反应是______(“吸热”或“放热”)反应。
(2)乳化池中,生石灰与水发生的反应类型是______。
(3)过筛的目的是拦截大于筛孔直径的颗粒,实验室中常用过滤来分离不溶于水的固体。过滤操作中需要用到玻璃仪器有玻璃棒的作用是______。过滤后滤液依然浑浊的原因可能是______。
(4)碳化塔中反应的化学方程式为______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属钛是重要的航天、航海材料,钛因其硬度大,熔点高,常温下不和非金属、强酸反应,被誉为“未来金属.”由钛铁矿(主要成分为钛酸亚铁,化学式为FeTiO3)、焦炭、氧气为原料,提取金属钛的主要工艺过程一般需要经过三个阶段:
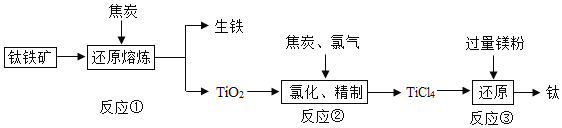
(1)反应前需要将钛酸亚铁和焦炭磨成粉末状的原因是______;钛酸亚铁(FeTiO3)中钛元素为______价.
(2)反应①中焦炭除了作还原剂还原金属矿物外,另一个重要作用是______.
(3)反应②中TiO2与C、Cl2在高温下反应,生成TiCl4和一种有毒气体,该气体是一种氧化物,其化学式为______.
(4)高温条件下,镁可以与TiCl4发生置换反应制得金属钛,请写出此反应的化学方程式______.
(5)如何从反应③后的固体中获得金属钛:______.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某课外兴趣小组为探究“蜡烛燃烧产物中含有哪些成分”,于是进行如下实验。
(查阅文献)蜡烛的主要成分是石蜡,石蜡是由碳、氢元素组成。
(猜想与假设)蜡烛燃烧的产物是二氧化碳和水。
(设计实验)
(1)将内壁涂有澄清石灰水的小烧杯罩在蜡烛火焰上方,发现烧杯内壁出现浑浊现象,证明有二氧化碳生成,其反应的化学方程式为_____。
(2)另取一只冷而干燥的小烧杯罩在蜡烛火焰上方,观察到_____,证明有水生成。在实验中,小华观察到一个异常现象:小烧杯内壁上产生少量黑色物质。
(交流与讨论)同学们一致认为该黑色物质可能是石蜡不完全燃烧生成的_____,理由是_____,据此,他们猜想还可能产生一氧化碳。
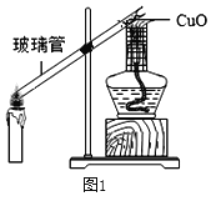
为验证存在该气体,小组成员设计图1所示的实验。
(设计实验)
(1)将玻璃管一段伸入蜡烛的焰心部分。
(2)用带有金属网罩的酒精灯加热另一端的氧化铜,一段时间后,观察到氧化铜由黑变红,证明蜡烛不充分燃烧有一氧化碳生成。对此,小明提出质疑:由以上现象不一定是生成了一氧化碳导致,还可能是_____。
同学们又在玻璃管中部放入_____重新实验,观察到黑色的氧化铜再次变红,由此确定蜡烛不充分燃烧有一氧化碳生成。
该兴趣小组欲利用数字化实验测定蜡烛发生不完全燃烧的产物,特设计如图2装置:收集含氧气50%的气体于钟罩内,将蜡烛点燃后放入钟罩,塞紧带有传感器的橡胶塞。实验过程中记录的相关数据如图3所示。请回答下列问题:
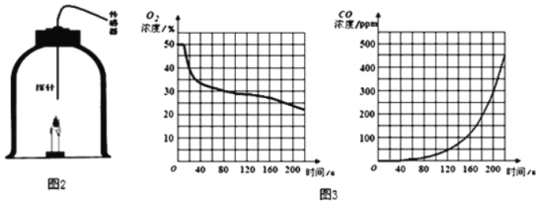
(1)在0~10s时,氧气浓度无明显变化的原因是_____。
(2)根据图象预测,蜡烛发生完全燃烧的时段为_____,结合图象说明理由_____。
(3)结合本实验记录的数据,写一条你的新认识_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是A、B、C三种固体物质的溶解度曲线图,请结合图示回答下列问题:
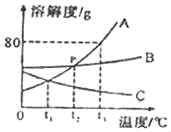
(1)p点的含义是_____。
(2)t3℃时,A物质的饱和溶液的质量分数为_____。
(3)室温下,将盛有C的饱和溶液的试管放入盛水的烧杯中,再向烧杯内的水中加入一定量的NaOH固体并搅拌,试管内可以观察到的现象是_____。
(4)要从B物质的饱和溶液中得到B物质的晶体,一般采用的方法是_____。
(5)将t3℃时A、B、C三种物质的饱和溶液降温到t1℃,所得溶液中溶质的质量分数由大到小的关系是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】据统计,我国每年报废的手机超过1亿部,若不进行有效回收利用,会造成巨大的浪费和污染。同学们对废旧手机中的金属回收产生兴趣。
(提出问题)
从废旧手机中可以回收到哪些有价值的金属?如何回收?

(查阅资料)
Ⅰ.手机电路板中的金属及其价格如下表所示:
种类 | Fe | Cu | Al | Ni | Au | Ag | Pd(钯) |
市场价格/($/t) | 365 | 7175.5 | 1710.5 | 14235 | 4.7×107 | 7.6×105 | 2.7×107 |
矿石中含量 | 72.4 | 0.87 | 29.1 | 1.02 | 4 | 120 | 0.4 |
手机电路板中含量 | 5 | 13 | 1 | 0.1 | 350 | 1380 | 210 |
说明:Fe、Cu、Al、Ni的含量用质量分数(%)表示,Au、Ag、Pd的含量的单位为“g/t”。
Ⅱ.Ni的金属活动性位于氢前;Pd的金属活动性位于氢后;NiCl2溶液为绿色。
(实验方案)

第一步:选择值得回收的金属。
依据资料Ⅰ中的数据,废旧手机中有回收价值的金属有Au、Ag、Cu、Pd,
(1)原因是:①它们的市场价格较高;②_____。
第二步:设计实验分离、回收部分金属。
序号 | 实验步骤 | 实验现象 |
Ⅰ | 取一废旧手机电路板,用电吹风机靠近电路焊接点的焊锡吹热风,一段时间后,用镊子将金属电路从塑料板中拽出 | 焊锡熔化 |
Ⅱ | 将金属电路放入烧杯中,加入过量10%的稀盐酸浸泡 | …… |
Ⅲ | 取Ⅱ中未溶解的金属电路,用蒸馏水洗净后,放入如上图所示装置中,进行实验。 | 溶液逐渐变成蓝色,仍有微量金属固体未溶解 |
Ⅳ | 过滤Ⅲ中烧杯中的物质,洗涤滤纸上的物质 | 滤纸上仍有微量金属固体 |
(问题讨论)
(2)由步骤I中的现象,可推知的焊锡的物理性质是_____(填字母)。
a.熔点低 b.硬度大 c.抗腐蚀性强
(3)步骤Ⅱ中实验室用溶质质量分数为37%、密度是1.18gmL-1的浓盐酸配制10%的盐酸185g,需要浓盐酸_____ml;配制该稀盐酸应选择的量筒量程(水的密度为1g/cm3)为_____(填字母)。
a.10ml b.50ml c.100ml d.200ml
(4)步骤Ⅱ所得溶液中,至少含有_____(填数字)种溶质,该步骤中对应的实验现象是_____。
(5)请写出步骤Ⅲ中,溶液变成蓝色的化学方程式_____。
(6)步骤Ⅳ中过滤操作用到的玻璃仪器有玻璃棒、_____和_____,其中玻璃棒的作用是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学在材料、能源的研究和开发中起到重要的作用。
(1)可燃冰的主要成分是甲烷水合物,化学式是 CH48H2O,在温度升高时会释放出甲烷。
①甲烷属于_____(填序号)。
A 混合物 B 纯净物 C 化合物 D 氧化物
②甲烷在充足的氧气中燃烧的生成物有_____。
(2)石墨烯(化学式为 C)是从石墨中分离出的单层石墨片,它是世界上已知的最薄、最 坚硬的新型材料,有良好的导电性和导热性。
①下列有关石墨烯的说法正确的是(______)
A 在常温下,化学性质活泼 B 硬度比金刚石小 C 能够导电和导热
②将甲烷(CH4)在铜基体上高温发生分解生成氢气和石墨烯(可观察到碳原子会沉积吸 附在铜的表面上生长成石墨烯),该反应的化学方程式是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】粗盐中除含有NaCl、泥沙外,还含有少量MgCl2、CaCl2、Na2SO4等杂质。某兴趣小组设计了如下实验除去粗盐中的杂质
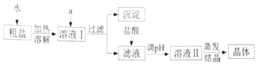
(1)试剂a包括:①过量的氢氧化钠溶液:②过量的氯化钡溶液;③过量的碳酸钠溶液。加入三种溶液的顺序是_____(填序号)。
(2)过滤后所得的沉淀中,除了泥沙外,还有_____(填化学式)
(3)过滤后,加入盐酸的目的是什么?_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是诺氟沙星胶囊的说明书,某患者遵医嘱,每次服用诺 氟沙星胶囊400mg,一段时间后病情有了好转.请回答以下问题:
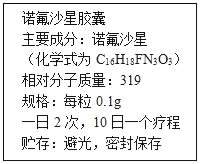
(1)诺氟沙星分子中碳、氢的原子个数比为_____.
(2)诺氟沙星分子中碳元素的质量分数是_____(精确到0.1%).
(3)从组成上可知诺氟沙星属于_____(填“有机化合物”或“无机化合物”);患者一个疗程共服用了_____粒诺氟沙星.摄入了_____mg氟元素.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com