
| A. | 它是由氧化铜、水和二氧化碳组成 | |
| B. | 它一定含有C、H、Cu元素,不含有O元素 | |
| C. | 它一定含有C、Cu元素,可能含有H、O元素 | |
| D. | 它由C、H、O、Cu四种元素组成 |
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 如图实验装置.请回答以下有关问题:
如图实验装置.请回答以下有关问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ④①⑤②③⑤ | B. | ④⑤②③⑤① | C. | ⑤②③④①⑤ | D. | ④①⑤③②⑤ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
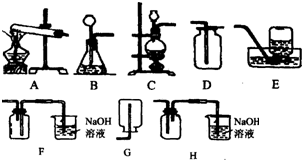
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 实验目的 | 所用试剂或方法 |
| A | 除去二氧化碳中少量的一氧化碳 | 通入氧气、点燃 |
| B | 除去氯化钠中少量的泥沙 | 溶于水、过滤 |
| C | 验证锌、铜、金的金属活动性 | 加盐酸 |
| D | 除去生石灰中少量的碳酸钙 | 加水充分搅拌 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com