
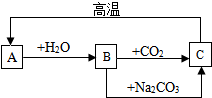
 A、B、C是三种常见的含钙化合物,它们之间有如图所示的转化关系(部分产物略去):
A、B、C是三种常见的含钙化合物,它们之间有如图所示的转化关系(部分产物略去):
| ||
| ||


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:初中化学 来源: 题型:
| 物质的质量 | 甲 | 乙 | 丙 | 丁 |
| 反应前 | 25g | 8g | X | 5g |
| 反应后 | 8g | 8g | 20g | 9g |
| A、x=6g |
| B、甲的化学计量数等于丙和丁的化学计量数之和 |
| C、乙物质一定是催化剂 |
| D、该反应是分解反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 事实 | 解释 | |
| A | 墙内开花墙外香 | 分子在不断地运动 |
| B | H2O2能杀菌消毒,而H2O不能 | 两种物质的分子构成不同 |
| C | 温度计中的水银热胀冷缩 | 原子的大小发生改变 |
| D | 湿衣服在阳光下易晾干 | 受热时分子运动速率加快 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:初中化学 来源: 题型:
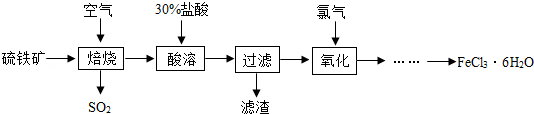
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、用燃烧的木条区别氧气和二氧化碳 |
| B、用酚酞区分石灰水和碳酸钠溶液 |
| C、用二氧化锰区分双氧水和蒸馏水 |
| D、用稀硫酸区分黄铜(Cu、Zn)和黄金 |
查看答案和解析>>
科目:初中化学 来源: 题型:
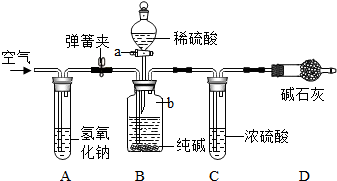
查看答案和解析>>
科目:初中化学 来源: 题型:
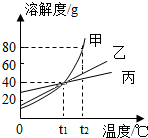
| A、t1℃时,甲、乙、丙三者的溶解度相等 |
| B、t1℃时,甲、乙、丙三者的溶液的溶质的质量分数一定相等 |
| C、分别把等质量的甲、乙两饱和溶液从t2℃降到t1℃时,两溶液析出晶体的质量甲大于乙 |
| D、t2℃时,往100g水中加入90g甲,充分搅拌后得到180g甲的溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com