
| 106 |
| x |
| 197 |
| 9.85g |
| 5.3g |
| 20g |
| 106 |
| x |
| 197 |
| 9.85g |
| 5.3g |
| 20g |


科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 酸、碱、盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动.
酸、碱、盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动.| 阴离子 阳离子 |
OH- | NO
|
Cl- | SO
|
CO
| ||||||
| H+ | 溶、挥 | 溶、挥 | 溶 | 溶、挥 | |||||||
| Ha+ | 溶 | 溶 | 溶 | 溶 | 溶 | ||||||
| Ba2+ | 溶 | 溶 | 溶 | 不溶 | 不溶 |
| 实验目的 | 实验操作 | 现象 | 结论或化学方程式 |
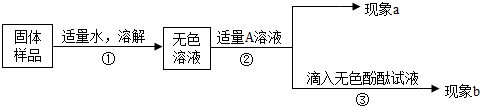
除去碳酸钠 |
取少量该固体样品溶于水配成溶液,滴加适量 的 充分反应后过滤 |
有白色沉淀生成 |
有关反应的化学方程式为 |
| 检验是否含有氢氧化钠 | 在滤液中滴加酚酞溶液 | 该样品中含有氢氧化钠 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 清洁剂名称 | 洁厕灵 | 84消毒液 |
| 有效成分 | HCl | NaClO |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com