
| ||
| ||


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
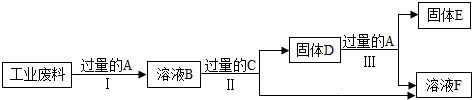
科目:初中化学 来源: 题型:
查看答案和解析>>
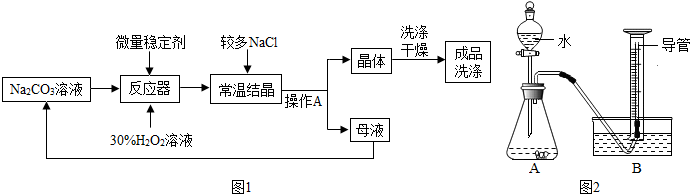
科目:初中化学 来源: 题型:
| 物质 | KCl | K2SO4 | NH4Cl | M |
| 溶解度/g(常温) | 34.0 | 11.1 | 37.2 | 19.5 |
查看答案和解析>>
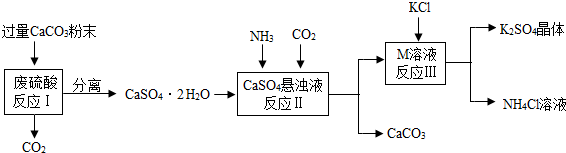
科目:初中化学 来源: 题型:
 已知A、B、C、D是初中化学常见的物质.它们之间的转化关系如图所示(部分物质和反应条件略去),其中A被看作是理想的“绿色能源”,B在常温下是无色液体,C可用于灭火.请回答下列问题:
已知A、B、C、D是初中化学常见的物质.它们之间的转化关系如图所示(部分物质和反应条件略去),其中A被看作是理想的“绿色能源”,B在常温下是无色液体,C可用于灭火.请回答下列问题:查看答案和解析>>
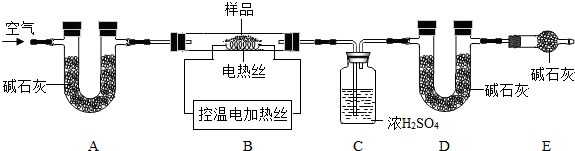
科目:初中化学 来源: 题型:
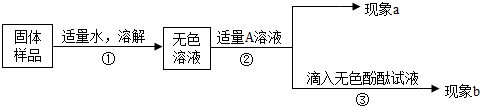
查看答案和解析>>
科目:初中化学 来源: 题型:
 儿童缺锌会引起食欲不振、发育不良.如图为某种补锌口服液说明书的一部分,请回答:
儿童缺锌会引起食欲不振、发育不良.如图为某种补锌口服液说明书的一部分,请回答:查看答案和解析>>
科目:初中化学 来源: 题型:
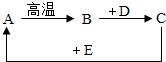 A、B、C、D、E是初中常见的物质.它们的转化关系如图所示(部分物质已略去),其中A、B、C中均含有相同的金属元素,D、E是植物进行光合作用的物质.
A、B、C、D、E是初中常见的物质.它们的转化关系如图所示(部分物质已略去),其中A、B、C中均含有相同的金属元素,D、E是植物进行光合作用的物质.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com