
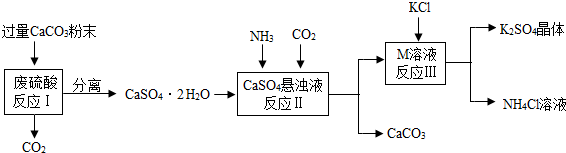
| 物质 | KCl | K2SO4 | NH4Cl | M |
| 溶解度/g(常温) | 34.0 | 11.1 | 37.2 | 19.5 |
| ||
| ||


科目:初中化学 来源: 题型:
| 温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 |
| KNO3 | 13.3 | 32 | 64 | 110 | 169 | 246 |
| NaCl | 35.7 | 36 | 36.6 | 37.3 | 38.4 | 39.8 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 物质 | 杂质 | 除去杂质的方法 | |
| A | CaO | CaCO3 | 加入足量的水溶解、过滤 |
| B | NaOH溶液 | Na2CO3 | 加入适量的Ca(OH)2溶液,过滤 |
| C | Cu(NO3)2溶液 | AgNO3 | 加入过量的铜粉,过滤 |
| D | CO | CO2 | 通过NaOH溶液,干燥 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:初中化学 来源: 题型:
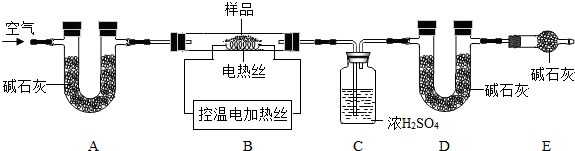
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 酸、碱、盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动.
酸、碱、盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动.| 阴离子 阳离子 |
OH- | NO
|
Cl- | SO
|
CO
| ||||||
| H+ | 溶、挥 | 溶、挥 | 溶 | 溶、挥 | |||||||
| Ha+ | 溶 | 溶 | 溶 | 溶 | 溶 | ||||||
| Ba2+ | 溶 | 溶 | 溶 | 不溶 | 不溶 |
| 实验目的 | 实验操作 | 现象 | 结论或化学方程式 |
除去碳酸钠 |
取少量该固体样品溶于水配成溶液,滴加适量 的 充分反应后过滤 |
有白色沉淀生成 |
有关反应的化学方程式为 |
| 检验是否含有氢氧化钠 | 在滤液中滴加酚酞溶液 | 该样品中含有氢氧化钠 |
查看答案和解析>>
科目:初中化学 来源: 题型:
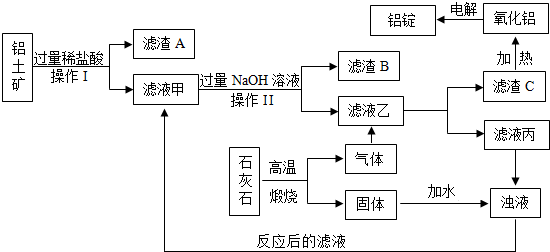
查看答案和解析>>
科目:初中化学 来源: 题型:
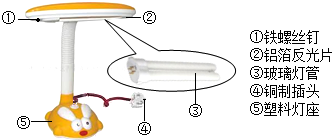 青少年一定要爱护自己的眼睛,在光线不足时看书、写字要用照明工具.如图是一种照明用台灯.
青少年一定要爱护自己的眼睛,在光线不足时看书、写字要用照明工具.如图是一种照明用台灯.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com