
【题目】氧化铜矿石含有CuO、Cu2(OH)2CO3和Fe2O3,还含有一些不溶于水、不溶于酸的其他杂质。铜、铁是畜禽所必需的微量元素,某饲料厂联合生产硫酸铜晶体和硫酸亚铁晶体的主要工艺流程如下。
【资料】Cu2+、Fe3+以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Cu(OH)2 |
开始沉淀的pH | 1.5 | 4.2 |
沉淀完全的pH | 3.7 | 6.7 |
请回答问题:
(1)氧化铜矿石粉碎的目的是________________________________。
(2)写出“酸浸”中发生反应的化学方程式__________________(任写一个)。
(3)该流程中氢氧化铁能与硫酸反应,其基本反应类型是_________反应。
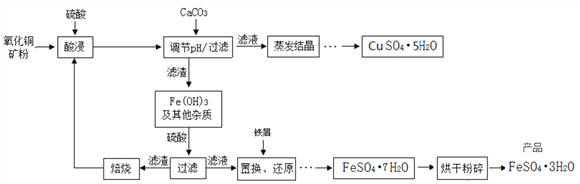
(4)下图为“硫酸亚铁干燥曲线图”,据此可确定由FeSO4·7H2O脱水得到流程中所示产品的适宜工艺条件为__________________(填写温度和时间)。
(5)在“调节pH/过滤”中,加入CaCO3调节溶液的pH,请说出溶液适宜的pH范围是____________。
【答案】 增大接触面积,加快充分反应 Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑ 复分解 125℃(±5) 4h 3.7-4.2
【解析】(1)根据反应物的接触面积与反应速率成正比进行分析;(2)根据碱式碳酸铜和稀硫酸反应会生成硫酸铜、水和二氧化碳进行分析;(3)根据酸碱中和属于复分解反应解答;(4)根据流程图及“硫酸亚铁干燥曲线图”分析解答;(5)根据表中以氢氧化物形式沉淀时溶液的pH分析解答。(1)反应物的接触面积与反应速率成正比,将氧化铜矿石粉碎,增大接触面积,加快充分反应;(2)碱式碳酸铜和稀硫酸反应生成硫酸铜、水和二氧化碳,反应的化学方程式为Cu2(OH)2CO3+2H2SO4=2CuSO4+3H2O+CO2↑;(3)氢氧化铁与硫酸反应,其基本反应类型是复分解反应;(4)由“硫酸亚铁干燥曲线图”可知,由FeSO4·7H2O脱水得到流程中所示产品(FeSO4·3H2O)的适宜工艺条件为125℃(±5)℃ ,时间为4h;(5)使Fe(OH)3形成沉淀,硫酸铜不形成沉淀而分离,结合pH表可知,适宜的pH范围是3.7-4.2。


科目:初中化学 来源: 题型:
【题目】(1)化学实验室要从X、银、铜、锌四种金属混合物中分离某贵重金属。流程如下:
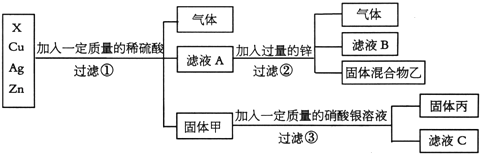
请回答:
①四种金属的活动性顺序由强到弱的是_________________;
②固体丙中一定含有的金属是__________________;
③写出③中反应的化学方程式_______________________;
④为了检验滤液C中的溶质成分:向其中加入稀盐酸,有白色沉淀产生,则滤液C中一定含有的阳离子___.
(2)配制50 g一定溶质质量分数的氯化钠溶液,实验步骤如下:

①计算:氯化钠质量和水的体积(水的密度:1.0 g/mL).
②称量:如上图1所示(右盘无砝码),称得的氯化钠质量为________g.
③溶解:把氯化钠和水全部转移到烧杯中,搅拌至氯化钠全部溶解,配得氯化钠溶液中溶质的质量分数为________(写出计算式和结果)。
④装瓶、贴标签。
⑤上述实验过程中,用量筒量取水时,若按上图2方式进行读数,将导致所配制溶液的溶质质量分数______(填“偏大”、“不变”或“偏小”)。
⑥若将上述50 g氯化钠溶液稀释为2%的氯化钠溶液,稀释过程中,不需要用到的仪器有______(填标号)。
A.量筒 B.漏斗 C.玻璃棒 D.托盘天平
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】烧杯中盛有CuCl2和HCl的混合溶液100g,向其中滴加10%的NaOH溶液,烧杯中溶液的质量与滴加溶液的质量关系如图所示。下列说法正确的是
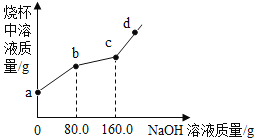
A. ab段反应产生蓝色沉淀
B. bc段溶液增加80g
C. c点对应的溶质质量分数为4.9%
D. d点溶液显碱性
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】订书钉是生活中常用文具,顾老师指导同学们围绕订书们钉开展实验研究。
实验步骤 | 实验内容 |
① | 用磁铁吸引订书钉,发现订书钉能被吸引 |
② | 取一个订书钉块(40根钉子)(如图甲所示),浸入酒精中,一段时间后能从订书钉块上取下一层胶水薄膜 |
③ | 取上述订书钉块用棉花擦去精,并待酒精完全挥发后称量其质量为13.4g |
④ | 将其放入图乙所示装置,并在干管口用氢气传感器测量氢气质量,同时记录质量变化 (如图丙所示) |
⑤ | 5.8分钟时停止反应取出装置剩余订书钉,洗涤、干操、称量,剩余订书钉质量为7.8g |
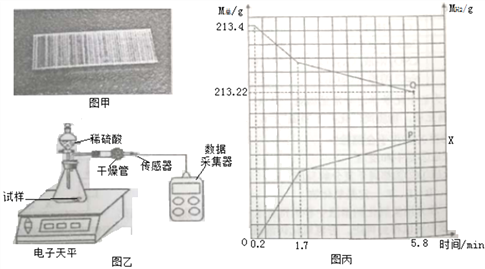
问题思考:
(1)订书钉表面涂胶水的目的主要是_______________;
(2)查阅资料可知:订书钉主要成分为铁,并在其表面镀一种金属。请结合图丙分析:
①图丙中P点纵坐标X的值_______________________;
②0→0.2分钟不产生氢气的原因主要是______________;
③请写出1.7分钟后装置中发生的主要化学反应方程式____________;
④订书钉表面镀的金属可能是钙、镁、铝、锌、铜中的一种,请根据实验分析该金属是_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向足量稀硫酸溶液中加入锌粉(仅含不溶于酸的杂质),充分反应,反应前后各物质的质量统计如图所示。求:
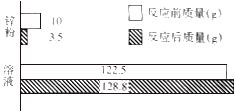
(1)锌粉中含有金属锌的质量为_____g。
(2)反应后,溶液中硫酸锌的质量分数为多少__________?(请写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两物质的溶解度曲线如图所示,下列叙述中正确的是( )
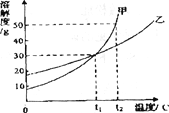
A. t1℃时,甲和乙的溶解度相等,都是30
B. t1℃时,将甲、乙两种物质的饱和溶液分别恒温蒸发等质量的水,析出晶体的质量一定相等
C. 温度从t2℃降至t1℃时,甲和乙的饱和溶液中析出晶体的质量甲大于乙
D. t2℃时,甲溶液的溶质质量分数一定大于乙溶液的溶质质量分数
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学加热33g氯酸钾和二氧化锰混合物制氧气,至混合物质量不再减少时得到23.4g固体。求:
(1)生成氧气的质量?
(2)反应前混合物中二氧化锰的质量分数?(计算结果保留至1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“宏观—微观—符号”三重表征是化学独特的表示物质及其变化的方式。请结合图示回答下列问题:
(1)用“![]() ”表示碳原子,“
”表示碳原子,“![]() ”表示氮原子,“
”表示氮原子,“![]() ”表示氧原子。
”表示氧原子。
①用“![]() ”表示的物质,固态时俗称为________________。
”表示的物质,固态时俗称为________________。
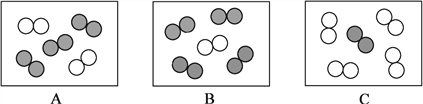
②同温同压下,气体的体积比等于分子个数比。若空气中其它成分忽略不计,下图可表示空气微观模型的是________________。(填字母,单选题)
(2)①图1中,“Fe”表示多种信息,如表示铁元素、铁单质,还能表示________________。
②观察图2和图3中微粒变化的共同点,可以得出酸碱中和反应的微观实质是___________。

(3)图4表示稀盐酸(左)稀硫酸(右)参加反应,图5表示将氯化钡溶液滴入稀硫酸中至恰好完全反应,反应前后溶液中存在的主要离子
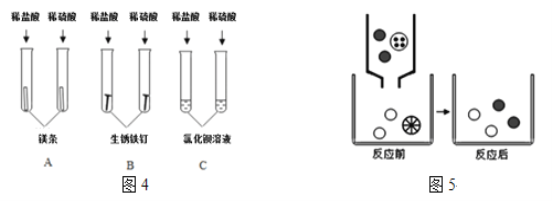
图4中不能体现酸的通性的是________(填字母序号);写出图5中图形代表的离子(填离子符号):![]() ________
________ ![]() ________
________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有一包粉末,已知由BaSO4、FeCl3、Ba(NO3)2、Na2SO4、NaOH、NaCl中的几种组成。为了确定其成分,现进行以下实验,各步骤均已充分反应。
步骤一:取一定质量的粉末,加水搅拌后过滤,得到有色沉淀甲和无色溶液A;
步骤二:向步骤一的沉淀甲中加入足量稀盐酸,固体全部消失并得到黄色溶液;
步骤三:将步骤一得到的无色溶液A进行如下图所示的实验。
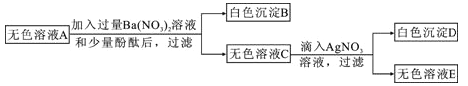
则下列说法中正确的是:
A. 原白色粉末中一定有FeCl3、Na2SO4、NaOH
B. 有色沉淀甲可能是Fe(OH)3和BaSO4 的混合物
C. 若将步骤二中的盐酸换成硝酸,则可确定原白色粉末是否含有NaCl
D. 原白色粉末中FeCl3和NaOH的质量比为65:48
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com