
【题目】烧杯中盛有CuCl2和HCl的混合溶液100g,向其中滴加10%的NaOH溶液,烧杯中溶液的质量与滴加溶液的质量关系如图所示。下列说法正确的是
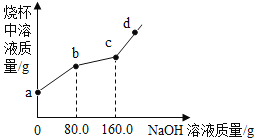
A. ab段反应产生蓝色沉淀
B. bc段溶液增加80g
C. c点对应的溶质质量分数为4.9%
D. d点溶液显碱性
【答案】D
【解析】A、溶液中有稀盐酸,故加入氢氧化钠后先与稀盐酸反应,故ab段没有沉淀生成,错误;
B、bc段是稀盐酸与氢氧化钠反应,反应氢氧化钠的质量为80.0g,有氢氧化铜生成,增加的质量表示80g,错误;
C、c点时氯化铜与氢氧化钠完全反应,氢氧化钠与稀盐酸反应生成氯化钠的关系为NaOH—NaCl,设生成氯化钠的质量为x
NaOH—-----NaCl
40 58.5
80g![]() x
x
![]() =
=![]() x=11.7g
x=11.7g
氢氧化钠与氯化铜反应生成氯化钠的数量关系为CuCl2-----2NaOH—---2NaCl---Cu(OH)2
设生成氯化钠的质量为m,生成氢氧化铜的质量为n
2NaOH—- --2NaCl---Cu(OH)2
80 117 98
80g![]() m n
m n
![]() =
=![]() =
=![]() m=11.7g,n=9.8g
m=11.7g,n=9.8g
反应后溶液中溶质的质量分数为![]() =9.4%,故错误;
=9.4%,故错误;
D、d点时,溶液中有过剩的氢氧化钠,故溶液显碱性,正确。故选D。


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:初中化学 来源: 题型:
【题目】用下列实验操作可完成两个实验。请从A或B 两题中任选一个作答,若两题均作答,按A 计分。
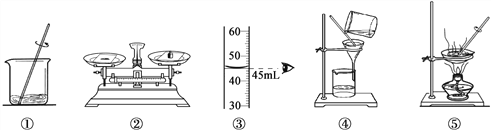
A去除粗盐中难溶性杂质 | B配制50g 10%的氯化钠溶液 |
(1)实验的操作步骤是___________(填序号)。 (2)实验中发现滤液浑浊,其原因是_____。 a.滤纸未贴紧漏斗内壁 b.滤纸破损 | (1)实验的操作步骤是____________(填序号)。 (2)实验后测得溶质质量分数<10%,其原因是_____。 a.装瓶时溶液洒出 b.烧杯中有水 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下列实验装置图,回答有关问题。
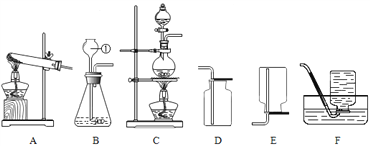
⑴写出仪器①的名称_____。
⑵实验室用A装置加热高锰酸钾制取O2的化学反应方程式为_______,还应对该装置进行的改进是________。实验室常用锌粒和稀硫酸反应制取氢气,若要得到一瓶较纯净的氢气,应选择的装置组合是___________。
⑶张老师要制取一瓶氯气(Cl2),反应原理是:MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑ + 2H2O。
MnCl2 + Cl2↑ + 2H2O。
已知常温下,氯气是一种黄绿色有刺激性气味的有毒气体,密度比空气的大,易与水反应生成盐酸和次氯酸(HClO)。张老师应选择的发生装置是____(填装置的字母代号),写出氯气与水反应的化学方程式__________。
⑷兴趣小组在做完盐的性质实验后,发现一瓶碳酸钠固体可能混入了氯化钠、硫酸钠中的一种或两种,为此,他们对这瓶固体的成分进行了探究。
Ⅰ.实验验证:
①取少量该样品于烧杯中,加入适量的水,溶解,得到溶液A。
②取少量溶液A于试管中,先滴入过量的稀硝酸,再滴入过量的硝酸钡溶液,充分反应后,静置。观察到先产生_______,后产生________,说明该固体中混有硫酸钠。
③取步骤②中的上层清液于试管中,滴入几滴硝酸银溶液。观察到产生白色沉淀,说明该固体中还混有_____。该步实验结束所得溶液中一定含有的阳离子是_____。
Ⅱ.实验拓展:兴趣小组还想测定该固体中碳酸钠的质量分数,利用如图所示的实验装置(气密性良好)进行实验,每一步反应均完全进行。
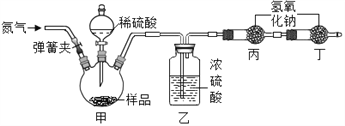
为达到实验目的,首先称取一定质量的该固体样品放入装置甲中,然后进行有关实验操作,正确的顺序是___(填序号,可重复)。
a.称量装置丙
b.打开弹簧夹,通入足量的氮气,关闭弹簧夹
c.打开分液漏斗的活塞,注入足量的稀硫酸,关闭活塞
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】取10.9g纯碱样品(含少量氯化钠杂质)完全溶于108.8g水中,再向其中逐滴加入100g溶质质量分数为20.8%的氯化钡溶液,恰好完全反应,所得溶液为不饱和溶液,请根据题意回答下列问题:
(1)100g溶质质量分数为20.8%的氯化钡溶液中氯化钡的质量为__g;
(2)完全反应后所得溶液中溶质的质量分数为多少_______? (写出计算过程)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某校化学兴趣小组用一瓶含有少量氯化钠的硫酸钠固体样品,进行如图所示的实验.

请根据以上信息计算(结果保留到小数点后两位):
(1)反应生成沉淀的质量为 。
(2)样品中氯化钠的质量。
(3)滤液中溶质的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室有一部分被氧化成氧化镁的镁粉样品、未知浓度盐酸和40%的氢氧化钠溶液。兴趣小组同学为分析样品中金属镁的质量百分含量和计算盐酸的质量分株,进行如下探究:
(1)用盐酸溶解样品(样品混合均匀),测定生成氢气质量。实验数据如下表所示:
实验序号 | 所取样品质量(g) | 所加盐酸质量(g) | 生成氢气质量(g) |
Ⅰ | 16.0 | 60.0 | 0.5 |
Ⅱ | 16.0 | 130.0 | 1.0 |
Ⅲ | 16.0 | 150.0 | 1.0 |
镁粉样品中金属镁的质量百分含量为_________________。
(2)向实验Ⅲ后的溶液中加入40%的氢氧化钠溶液,生成沉淀的质量随加入氢氧化钠溶液质量的变化关系如图所示。计算盐酸的质量分数。(写出计算过程)
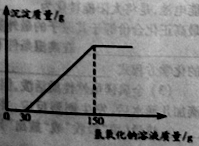
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“镉大米”是指大米中镉元素超出了国家食品安全标准。有研究表明,人体摄入镉过量会引发肾功能障碍并导致“痛痛病”、软骨病等。由于水稻生长对土壤中的镉有富集作用,进而导致大米中的镉被人体吸收的概率增加,所以治理土壤中的镉污染刻不容缓。请根据以上信息回答14-16题。
【1】摄入的镉元素主要危害人体中的物质是
A. 蛋白质 B. 淀粉 C. 维生素 D. 油脂
【2】经研究发现长期使用磷肥将增加土壤中的镉含量,以下属于磷肥的是
A. 氯化钾KCl B. 碳酸氢铵NH4HCO3
C. 磷酸二氢钙Ca(H2PO4)2 D. 磷酸二氢铵NH4H2PO4
【3】同时研究表明水稻对镉的吸收率与土壤的pH有紧密关系(如图所示),因此以下物质可用于改良土壤结构,用于降低水稻对镉吸收的有
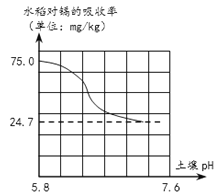
A. 烧碱 B. 熟石灰 C. 汽水 D. 稀盐酸
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氧化铜矿石含有CuO、Cu2(OH)2CO3和Fe2O3,还含有一些不溶于水、不溶于酸的其他杂质。铜、铁是畜禽所必需的微量元素,某饲料厂联合生产硫酸铜晶体和硫酸亚铁晶体的主要工艺流程如下。
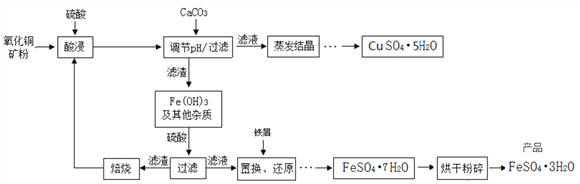
【资料】Cu2+、Fe3+以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Cu(OH)2 |
开始沉淀的pH | 1.5 | 4.2 |
沉淀完全的pH | 3.7 | 6.7 |
请回答问题:
(1)氧化铜矿石粉碎的目的是________________________________。
(2)写出“酸浸”中发生反应的化学方程式__________________(任写一个)。
(3)该流程中氢氧化铁能与硫酸反应,其基本反应类型是_________反应。
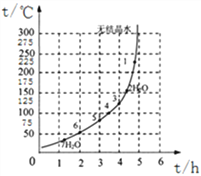
(4)下图为“硫酸亚铁干燥曲线图”,据此可确定由FeSO4·7H2O脱水得到流程中所示产品的适宜工艺条件为__________________(填写温度和时间)。
(5)在“调节pH/过滤”中,加入CaCO3调节溶液的pH,请说出溶液适宜的pH范围是____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】赣南的客家围屋如同城堡,可以抵御外敌入侵。现有五种物质盐酸、硫酸、氢氧化钠、 氯化钡和碳酸钠作为围屋的守护“卫士”,只有相邻物质间能发生反应才能组成守护的防线(如下图所示)。其中物质A的浓溶液有脱水性,炉具清洁剂中常常含有B物质,物质C是人体胃液中的主要成分。
(1)B物质的水溶液的pH______7(填“>” “=”或“<”)。
(2)C与D反应的化学方程式为_______________________________。
(3)A与E反应时的实验现象为_________________________________。
(4)现有下列物质作为“外敌”分别对围屋发起进攻,若该物质与两位相邻的守护“卫士”都能发生反应才能攻破防线,那么能攻入围屋的物质是________(填序号)。
①铁 ②二氧化碳 ③氢氧化钡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com