
【题目】将盛有等质量、等质量分数且足量的稀盐酸的两只烧杯,放在托盘天平的左右两盘,天平平衡.在左盘烧杯中加入10克碳酸钙,若要使天平重新平衡,则右盘烧杯中应加入的物质可能是( )
A.10克碳酸钾和碳酸钠 B.10克碳酸镁和碳酸钠
C.5.5克氧化铜 D.10克镁粉和铜粉
【答案】B
【解析】
试题设左边烧杯中产生的二氧化碳的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
10g x
![]()
x=4.4g
左边烧杯的质量增加量为:10g﹣4.4g=5.6g,也就是说右边烧杯的质量增加量也为5.6g天平才能保持平衡.
A、由于碳酸钙的相对分子质量是100,所以要想在加入10g碳酸盐的混合物生成的二氧化碳也是4.4g,必须是两种碳酸盐的相对分子质量一个大于100另一个小于100,而碳酸钾的相对分子质量是138、碳酸钠的相对分子质量是106,都大于100,故该选项错误;
B、由A的分析进行判断,碳酸镁的相对分子质量是84、碳酸钠的相对分子质量是106,所以加入10克碳酸镁和碳酸钠有可能使天平平衡;
C、氧化铜与盐酸反应不会生成气体,所以加入5.5克氧化铜则右盘会增重5.5g,所以天平不会平衡;
D、由于镁与盐酸反应能生成氢气,而铜不能与盐酸反应,假设该金属全部是镁,设生成氢气的质量是y
Mg+2HCl═MgCl2+H2↑
24 2
10g y
![]()
y=0.83g
故不管是镁铜以何种比例混合右盘的增重一定大于5.6g;天平不能平衡;
故选B


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案科目:初中化学 来源: 题型:
【题目】请结合图所示实验装置回答有关问题:
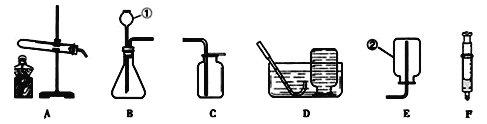
(1)写出装置图中标号仪器名称:①_____________;②______________。
(2)小强用高锰酸钾制取较纯净的氧气,他应选择的发生装置是______,收集装置是______,反应的化学方程式是________。证明氧气已收集满的方法是______。停止该实验的正确操作步骤是先_______________再_______,否则会导致______。
(3)检查装置B气密性的方法是:用注射器F检查装置B的气密性,步骤如下:
①向锥形瓶中加水至_______以形成液封;
②将注射器F连接到装置B的导管口处;
③缓慢往外拉动注射器F的活塞,观察到________,表示装置B的气密性良好。若实验室用该装置制取CO2气体,选择的固体药品是____________(填写物质名称)。
该装置的不足之处是:不能控制反应随时发生、随时停止。可对装置B加以改进,请写出一种改进方案:
友情提示:你可从图所示的用品中选取,也可自行选用其它仪器。
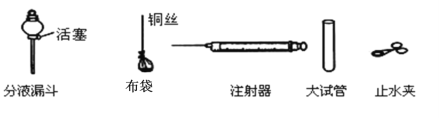
方案:_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】以下是老师引导学生探究“质量守恒定律”的教学片段,请你参与探究并帮忙填写空格(包括表中的空格)。
(提出问题)化学反应前后各物质的质量总和是否相等?
(猜想与假设)猜想1:不相等; 猜想2:相等。
(实验探究)甲、乙两组同学用托盘天平分别称量反应前后物质的质量。
甲 组 | 乙 组 | |
实验方案(反应后略) |
|
|
实验现象 | 有气泡产生, 天平指针向右偏转 | 铁钉表面有红色物质析出, 溶液颜色发生改变, 天平指针没有偏转 |
结论 | 猜想1正确 反应的化学方程式:____ | 猜想2正确 |
(反思评价)究竟哪种猜想正确?通过讨论,同学们发现甲组中有气体溢出,导致指针向右偏转。得到启示:在探究化学反应前后各物质的质量总和是否相等时,凡是有气体生成或参加的反应一定要在_____中进行。
(优化装置)同学们对甲组左盘中的反应装置进行了如下两种改进,你认为最佳装置是_______(填序号)。
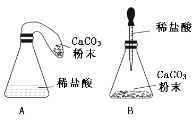
(得出结论)同学们利用改进后的最佳装置进行再次探究,均得出猜想二正确。最终得出结论是:_____的各物质的质量总和等于反应后生成的各物质的质量总和。
(解释应用)解释:化学反应前后,原子的种类、数目、质量均不变,所以质量守恒。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某纯净物3 g在氧气中完全燃烧,生成8.8 g二氧化碳和5.4 g水。下列说法不正确的是( )
A. 该反应中O2和CO2的质量比为14∶11 B. 该纯净物中含有C、H元素,不含O元素
C. 该纯净物中C、H原子的个数比为1∶4 D. 该反应中O2和H2O的分子数之比为7∶6
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是氢氧化钠溶液与稀盐酸恰好完全反应的微观示意图,下列结论错误的是( )
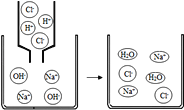
A. 反应结束时溶液的pH=7
B. 反应前后元素的种类没有变化
C. 反应后溶液中存在的粒子只有Na+和Cl﹣
D. 该反应的实质是H+和OH﹣结合生成水
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国制碱工业的先驱侯德榜将制碱与制氨结合起来的联合制碱法,为纯碱和氮肥工业技术的发展做出了杰出的贡献.其生产工艺流程示意图如下:
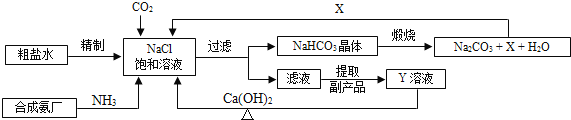
(1)粗盐水中主要含有Ca2+、Mg2+、SO42-等杂质离子,工业上常用加入稍过量的NaOH溶液、Na2CO3溶液、BaCl2溶液及适量的盐酸等除杂、精制.则加入试剂合理的顺序为 ________、盐酸(只写一种).加盐酸的作用是(用化学方程式表示) ___________、 _________.
(2)制碱原理为:NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl,该反应原理可看作是由:①CO2+NH3+H2O=NH4HCO3和②NaCl+NH4HCO3=NaHCO3↓+NH4Cl两个反应加合而成,则该反应类型为 __________.
(3)X的化学式为 ___________.
(4)Y是滤液中最主要成分,Y与Ca(OH)2反应的产物之一可用于循环使用,该产物的名称为 _______,Y的化学式 __________,写出Y的一种用途 ____________.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请从A或B两题中任选1个作答,若两题均作答,按A计分。
A | B |
(1)该反应的化学方程式为_____。 (2)用排水集气法收集O2的原因 是______。 |
将紫色石蕊溶液浸泡并晾干的小花,一半喷水后放入集气瓶中,实验的现象是______,该实验中主要化学方程式是______。 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示是测定空气里氧气含量的装置、气密性良好,在集气瓶内加入少量水,将水面上方空间分为5等份。用弹簧夹夹紧橡皮管、点燃红磷后,迅速伸入集气瓶中并塞紧塞子;待燃烧停止并冷却至室温后,打开弹簧夹。
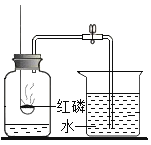
(1)红磷燃绕的化学方程式为__________________。
(2)打开弹簧夹后,烧杯中的水能够进入到集气瓶中的原因是:_______________。
(3)实验结束,进入集气瓶中水的体积小于瓶内空间的五分之一,可能的一种原因是_________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示装置可用于测定空气中氧气含量.下列说法不正确的是
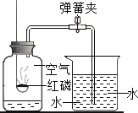
A. 红磷燃烧一停止立即打开弹簧夹
B. 实验前一定要检查装置的气密性
C. 该实验可证明氧气约占空气总体积的![]()
D. 将红磷换成硫粉,瓶中的水换成氢氧化钠溶液进行实验,也能得出相同结论(SO2能被氢氧化钠溶液吸收)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com