
分析 根据提供的物质结合物质的性质进行分析解答,碳酸钙是不溶于水的物质,铁是不溶于水的物质,铁能与盐酸反应生成氢气,碳酸钙能与盐酸反应生成二氧化碳气体;根据盐酸的用量确定生成的气体的种类;根据加入硝酸钡产生的沉淀的质量确定物质的类别,据此解答.
解答 解:(1)称量滤渣质量为12.32g,向滤渣中滴加10%的稀盐酸至不再产生气体,共消耗稀盐酸73g,收集产生的气体,检验出气体质量为3.56g,铁与盐酸反应生成氯化亚铁和氢气,若是全部生成氢气,设氢气的质量为x,
Fe+2HCl═FeCl2+H2↑
73 2
73g×10% x
$\frac{73}{2}=\frac{73g×10%}{x}$ x=0.2g
碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,设二氧化碳的质量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑
73 44
73g×10% y
$\frac{73}{44}=\frac{73g×10%}{y}$ y=4.4g
现在生成的气体的质量为3.56g,故含有氢气和二氧化碳;
故填:氢气和二氧化碳;
(2)设生成3.56g气体,铁消耗的盐酸的质量为a,生成的氢气的质量为b,
Fe+2HCl═FeCl2+H2↑
73 2
a b
$\frac{73}{2}=\frac{a}{b}$
则碳酸钙消耗的盐酸的质量为7.3g-a,生成的二氧化碳的质量为3.56g-b
CaCO3+2HCl═CaCl2+H2O+CO2↑
73 44
7.3g-a 3.56g-b
$\frac{73}{44}=\frac{7.3g-a}{3.56g-b}$
a=1.46g,故碳酸钙消耗的盐酸的质量为“7.3g-1.46g=5.84g
设铁的质量为x
Fe+2HCl═FeCl2+H2↑
56 73
x 1.46g
$\frac{56}{73}=\frac{x}{1.46g}$ x=1.12g
设碳酸钙的质量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73
y 5.84g
$\frac{100}{73}=\frac{y}{5.84g}$ y=8g
而滤渣的质量为13.32g,故一定含有铜,铁能与硫酸铜反应生成硫酸亚铁和铜,故一定含有硫酸铜,
故填:根据产生气体为3.56g可计算出滤渣中含铁1.12g和含碳酸钙8g,所以12.32g的滤渣中应该还含有其他固体,只能为铜;
(3)滤渣中含有铁和碳酸钙,能与盐酸反应生成氯化亚铁,碳酸钙能与盐酸反应生成氯化钙,故填:氯化钙和氯化亚铁;
(4)铜的质量为12.32g-1.12g-8g=3.2g,设硫酸铜的质量为x
Fe+CuSO4=FeSO4+Cu
160 64
x 3.2g
$\frac{160}{64}=\frac{x}{3.2g}$ x=8g
8g硫酸铜生成的硫酸钡的质量为y
CuSO4+Ba(NO3)2=Cu(NO3)2+BaSO4↓
160 233
8g y
$\frac{160}{233}=\frac{8g}{y}$ y=11.65g
而加入硝酸钡以后生成的沉淀的是23.3g,故一定含有硫酸钠;
故一定含有的物质是铁、硫酸铜、碳酸钙和硫酸钠,故填:铁、硫酸铜、碳酸钙、硫酸钠;
(5)铁能与盐酸反应生成氯化亚铁和氢气,故填:Fe+2HCl═FeCl2+H2↑;
(6)如果明确样品质量,可以确定氯化钠是否存在,故填:能.
点评 本题为常见的物质成分的推断,解答本题的关键是要掌握物质的性质,本题难度较大,要细心梳理解答.


科目:初中化学 来源: 题型:多选题
| A. | 白色粉末中一定含有氯化钠 | |
| B. | 无色溶液B中一定含有两种溶质 | |
| C. | 白色粉末中不含碳酸钙、硫酸钠、硫酸铜 | |
| D. | 步骤③生成的气体质量可能是4.4g |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
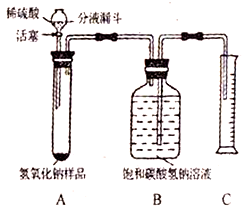 实验室有一瓶长期暴露在空气中已变质的氢氧化钠固体样品,某兴趣小组的同学对该样品的碳酸钠含量进行了探究.
实验室有一瓶长期暴露在空气中已变质的氢氧化钠固体样品,某兴趣小组的同学对该样品的碳酸钠含量进行了探究.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤 | 观察到的现象 | 结论 |
| (1)取上述试管中的上层清液,滴加1~2滴无色酚酞试液 | 酚酞溶液不变红 | 碳酸钙 |
| (2)往上述试管内残留的固体中加入稀盐酸 | 由气泡生成 | 白色粉末中含有碳酸钙 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com