
分析 根据氢氧化钠和铝反应生成偏铝酸钠和氢气,盐酸和铝反应生成氯化铝和氢气,然后结合题中所给的数据进行解答.
解答 解:2Al+6HCl=2AlCl3+3H2↑,2Al+2NaOH=2NaAlO2+3H2↑,
(1)通过化学方程式可以看出,等质量的两份铝分别与足量的盐酸、氢氧化钠溶液反应,金属是不足的,所以生成氢气的物质的量相等,所得H2的体积之比是:1:1;
(2)足量的两份铝分别投入到等体积、等物质的量浓度的盐酸、氢氧化钠溶液中,氢氧化钠和盐酸是不足的,通过化学方程式可以看出,1mol的盐酸会生成0.5mol的氢气,1mol的氢氧化钠会生成1.5mol的氢气,所以产生H2的体积之比是1:3;
(3)足量的两份铝分别投入到等体积、一定物质的量浓度的HCl、NaOH溶液中,二者产生的H2相等,通过化学方程式可以看出,生成1mol的氢气需要盐酸2mol,需要氢氧化钠$\frac{2}{3}$mol,所以HCl和NaOH的物质的量浓度之比是:3:1;
(4)盐酸和NaOH溶液中的溶质的物质的量均为:100mL×$\frac{1}{1000}$×3mol•L-1=0.3mol,
通过化学方程式可以看出,测得生成的气体体积比为V(甲):V(乙)=1:2,所以生成的氢气物质的量之比是1:2,
设铝与酸完全反应时,生成的氢气的物质的量为x
2Al+6HCl=2AlCl3+3H2↑
2 6 3
0.3mol x
$\frac{6}{0.3mol}$=$\frac{3}{x}$
x=0.15mol
一定条件下气体的物质的量之比等于体积之比,所以氢氧化钠和铝反应生成的氢气的物质的量为:0.15mol×2=0.3mol,
碱与金属完全反应时,设碱与金属反应的物质的量为y
2Al+2NaOH=2NaAlO2+3H2↑
2 3
y 0.3mol
$\frac{2}{y}$=$\frac{3}{0.3mol}$
y=0.2mol
所以铝的质量为:0.2mol×27g/mol=5.4g
故选:A.
故答案为:(1)1:1;
(2)1:3
(3)3:1;
(4)A.
点评 本题主要考查了氢氧化钠、盐酸和铝反应的化学方程式的计算,难度不大,需要认真分析题意即可解答.


 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 若甲、乙、丙、丁均是化合物,则该反应一定是复分解反应 | |
| B. | 若甲是一氧化碳,乙是金属氧化物,则丙一定是二氧化碳 | |
| C. | 若甲、乙、丙分别是酸、碱、盐,则丁一定是水 | |
| D. | 若甲是锌,丙是氢气,则乙一定是稀硫酸 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 在研制新材料的过程中,化学将起到十分重要的作用 | |
| B. | 生产、生活中所用物质都来自于自然 | |
| C. | 所有的自然现象都可以归属化学研究的范畴 | |
| D. | 化学工业给人类带来的只有益处没有坏处 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 某化学小组以“酸碱盐”为主题,进行了一系列的实验探究活动.
某化学小组以“酸碱盐”为主题,进行了一系列的实验探究活动.| 实验内容 | 实验现象 | 解释与结论 |
| 取反应后少量溶液于试管中,加入固体化合物. | (加CaCO3),有气泡产生. | 盐酸过量 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
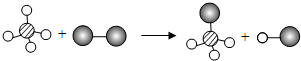
| A. | 图示中共有4种分子 | |
| B. | 该反应属于置换反应 | |
| C. | 该反应符合质量守恒定律 | |
| D. | 该图示说明在化学变化中分子可分,原子不可分 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com