随着社会的进步,我国的汽车工业发展迅速.现在汽车的安全性增加了,尾气的排放更加符合国际标准.围绕这两项内容,回答下列问题:
(1)为保证驾乘人员人身安全,增设了安全气囊,汽车的安全气囊在汽车发生一定强度的碰撞时,利用叠氮化钠(NaN3)发生分解反应,迅速产生氮气和固态钠,气体充满气囊,以达到保护驾乘人员的目的.
①写出叠氮化钠分解反应的化学方程式______.
②若常温、常压下,要产生70L的氮气,则需要完全分解______g的叠氮化钠.(已知:常温常压下,氮气的密度约为1.2g/L.)
(2)在汽车尾气系统中装置催化转化器.
①催化转化器可有效降低尾气中的CO、NO、NO2和碳氢化合物等有害物质向大气中排放.催化转化器中通常采用铂等贵重金属作催化剂.请写出CO和NO在催化剂的作用下发生反应生成CO2和N2的化学方程式______.
②催化转化器能减少一些有害气体的排放,但它并不能减少CO2气体的排放.CO2气体的大量排放能引起温室效应.为降低温室效应造成的危害,有人认为,空气中二氧化碳的含量越低越好,你认为这种说法是否正确?为什么?______.
解:(1)①根据叠氮化钠(NaN
3)发生分解反应,迅速产生氮气和固态钠,可知反应物是叠氮化钠,生成物是钠和氮气,用最小公倍数法配平即可;氮气后面标上上升符号;
②氮气的质量为:70L×1.2g/L=84g,设要生成84g氮气需要分解叠氮化钠质量为X则:
2NaN
3═2Na+3N
2↑
130 84
X 84g
根据:
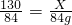
解得X=130g;
(2)①根据CO和NO在催化剂的作用下发生反应生成CO
2和N
2可知反应物是CO和NO;生成物是CO
2和N
2;在氮气前面加上

再在方程式两边同时乘以2就平了,反应条件催化剂写在等号上边;
②由于二氧化碳是参与光合作用的原料,如果二氧化碳量少了,光合作用弱了,释放出来的氧气就少了,人类和动物就不能很好的呼吸,所以二氧化碳不能越低越好.
故答案为:(1)①2NaN
3═2Na+3N
2↑ ②130
(2)①2CO+2NO
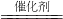
2CO
2+N
2 ②不正确.因为大气中的二氧化碳参与自然界的许多变化,直接影响着我们的生活.没有二氧化碳,绿色植物就无法通过光合作用为其他生物提供食物和充足的氧气.
分析:(1)①根据方程式的书写考虑;②根据方程式进行计算即可;(2)①根据方程式的书写方法考虑;②根据二氧化碳的用途考虑.
点评:解答本题的关键是方程式的书写,要学会从题干中获得反应物和生成物的信息,还需要知道二氧化碳的用途才能回答本题.

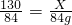 解得X=130g;
解得X=130g; 再在方程式两边同时乘以2就平了,反应条件催化剂写在等号上边;
再在方程式两边同时乘以2就平了,反应条件催化剂写在等号上边;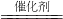 2CO2+N2 ②不正确.因为大气中的二氧化碳参与自然界的许多变化,直接影响着我们的生活.没有二氧化碳,绿色植物就无法通过光合作用为其他生物提供食物和充足的氧气.
2CO2+N2 ②不正确.因为大气中的二氧化碳参与自然界的许多变化,直接影响着我们的生活.没有二氧化碳,绿色植物就无法通过光合作用为其他生物提供食物和充足的氧气.

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案