
【题目】H2O2可作增氧剂。常温下,用4%H2O2溶液进行实验,研究pH对H2O2分解所得溶液中氧量的影响,测定结果如图。

(1)H2O2分解的化学方程式为____________________。
(2)分析如图得到的结论是_______________。
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】下图是两个实验小组分别进行“加热硫酸铜和氢氧化钠溶液反应后生成物”的实验过程示意图:

【甲组】氢氧化钠与硫酸铜反应的化学方程式为 ,加热后产生黑色的氧化铜。
【乙组】为寻找实验中没有产生氧化铜的原因,他们进行了以下实验探究:
【查阅资料】在酸性条件下,氢氧化钠与硫酸铜在溶液中可发生如下反应:
6NaOH+4CuSO4 3Na2SO4+Cu4(OH)6SO4 ↓,生成的碱式硫酸铜是不溶于水的蓝白色固体,加热不易发生分解。
【提出猜想】根据资料分析,同学们针对试管中溶液呈酸性的原因作出以下猜想:
猜想Ⅰ:硫酸铜溶液呈酸性; 猜想Ⅱ:生成的硫酸钠使溶液呈酸性。
【实验与结论】
实验①:用pH试纸测定硫酸铜溶液的酸碱度,得出其pH (填“﹥”、“﹤”或“﹦”),硫酸铜溶液呈酸性,猜想Ⅰ成立。
实验②:向盛有硫酸钠溶液的试管中逐滴加石蕊溶液,观察到溶液显紫色,硫酸钠溶液呈 (填“酸”、“中”或“碱”)性,猜想Ⅱ不成立。
【交流和反思】
(1)乙组同学认真分析甲组实验后,一致认为不需要通过实验就能判断猜想Ⅱ不成立,理由是 ;
(2)在化学反应中,相同的反应物因质量比不同可能会导致生成物不同,请另举一列 (写出反应物即可)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】阿司匹林可以缓解轻度或中度疼痛,化学式为C9H8O4,完成下列问题:
(1)阿司匹林由_____种元素组成,其中C、H、O元素原子个数比为_____;
(2)阿司匹林的摩尔质量为_____;
(3)阿司匹林中氧元素的质量分数为_____(列式计算,精确到0.1%)。
(4)0.25mol C9H8O4分子中约含有_____个氧原子(用科学记数法表示)。
(5)0.5mol C9H8O4的氢原子与_____g水中的氢原子个数相同。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学实验是科学探究的重要途径。
(1)在实验室,浓硫酸要密封保存的原因是______。(填字母代号)
a.防潮解 b.防挥发 c.防氧化 d.防吸水
(2)探究小组的同学设计如图所示的微型实验装置来探究二氧化碳的制法和性质,打开弹簧夹,并推压加液器的活塞加入盐酸。
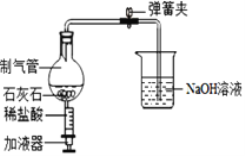
①写出制气管中发生反应的化学方程式______
②当制气管中盐酸消耗完,反应停止一段时间后,可观察到什么现象______?
③该制气管具有控制反应开始与结束的优点,利用该优点,还可以制取其他气体, 写出其反应方程式______。
(3)探究小组的同学利用下图装置做CO还原CuO的实验,并检验气体产物,已知混合气体中还含有CO2和H2O。
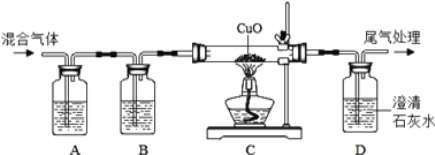
①A、B装置中应分别盛放什么试剂______?
②装置C中可观察到什么实验现象______?
③CO2制取的发生装置与氢气相同,请在方框中画出CO2发生装置图______(只画试管和导气管)

(4)向一定量的碳酸钠粉末中加入100g的稀盐酸,反应一段时间后,固体全部溶解,溶液的质量增加到了106.2g,求碳酸钠粉末的质量______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甘氨酸钠(C2H4NNaO2)是用于有机产品的合成及生化研究的。根据甘氨酸钠的化学式计算:
(1)甘氨酸钠由______种元素组成;
(2)甘氨酸钠的相对分子质量为______;
(3)甘氨酸钠中碳、氢、氮、氧元素的质量比为______(写最简比);
(4)若甘氨酸钠中含有4.6g钠元素,则该甘氨酸钠的质量为______g。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为了测定金属镁样品中镁的质量分数(杂质不含镁元素,不溶于水,也不与其它物质发生反应),进行了如下实验:请回答下列问题:
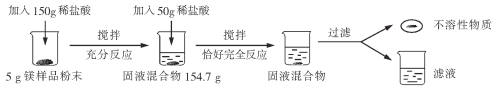
(1)上述实验过程中发生反应的化学方程式为________________________________。
(2)根据已知条件列出求解第一次所加的稀盐酸中溶质质量(x)的比例式________________。
(3)此镁样品中镁的质量分数为________________。
(4)用36.5%的浓盐酸配制200g上述稀盐酸,所需浓盐酸的质量为________________。
(5)若将反应后的滤液蒸发104.4g水,无晶体析出,所得溶液中溶质的质量分数为__________。
(6)若要生产含镁4.5%的铝合金960t,需要上述金属镁样品的质量为________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】教育部从2018年开始,要求在学校普及垃圾分类回收处理的相关知识。某化学活动小组结合所学的知识对此进行一系列实践活动。
I.活动探究
(1)学会识图分拣垃圾:下列垃圾应投人带有下图图标的垃圾箱内的是_________ (填字母序号)。

A 塑料瓶 B 果皮 C 碎瓷片
(2)学会检验有害气体含氯塑科焚烧时会产生氯化氢等气体。若要检验焚烧后的气体中有氯化氢,可将其通入__________溶液中,有白色沉淀生成即可。
II.实验探究:
[提出问题]如何回收处理废旧电池中的镉?
[查阅资料]
(1)废旧电池中含有锅、汞等元素,这些元素会危害人类健康。
(2)镉(Cd)从溶液中析出时呈海绵状固体.在化合物中通常表现为+2价。
(3)碳酸镉(CdCO3)、氢氧化镉Cd(OH)2都是白色固体、难溶于水。
[设计实验]先将废旧电池进行处理以制得硫酸镉(CdSO4)溶液,用于以下实验。
实验设计 | 实验步骤 | 实验现象 | 实验结论 |
与金属反应 | 取少许溶液于试管中,加入足量的Zn粉,充分反应 | ________ | Zn可以置换出Cd |
与碱反应 | 取少许溶液于试管中,加入足量的氢氧化钠溶液,充分反应 | 产生白色沉淀 | 用化学方程式表示为_________ |
与盐反应 | 取少许溶液于试管中,加入足量的________ 溶液,充分反应。 | 产生白色沉淀 | 可用该试剂除去CdSO4 |
[回收处理]
实验结束后,将反应后的混合物通过过滤洗涤、加热,进而再制得镉。
[交流反思]
请同学们]基于化学视角说明垃圾分类回收处理的重要意义_____(答一点即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com