
【题目】完成下列变化的化学方程式,并按要求填空。
(1)常温下铝和氧气反应:_______,铝制品不易锈蚀的原因_______。
(2)加热碳酸氢钱粉末:_______,该反应是_______ (选填“吸热”或“放热”)反应。
(3)镁条投入稀盐酸中:_______,基本反应类型_______。
(4)氨气(NH3)与氧化铜在加热条件下反应生成氮气、一种红色固态物质和一种无色液态物质__________。
【答案】 4Al+3O2═2Al2O3 铝的表面有一层致密的氧化铝薄膜 Ca(HCO3)2![]() CaCO3↓+H2O+CO2↑ 吸热 Mg+2HCl═MgCl2+H2↑ 置换反应 2NH3+3CuO
CaCO3↓+H2O+CO2↑ 吸热 Mg+2HCl═MgCl2+H2↑ 置换反应 2NH3+3CuO![]() 3Cu+N2+3H2O
3Cu+N2+3H2O
【解析】(1)常温下铝和氧气反应生成氧化铝,反应的化学方程式为:4Al+3O2═2Al2O3;铝制品不易锈蚀的原因铝的表面有一层致密的氧化铝薄膜;(2)加热碳酸氢钙粉末生成碳酸钙、水和二氧化碳,反应的化学方程式为:Ca(HCO3)2![]() CaCO3↓+H2O+CO2↑;该反应是吸热反应;(3)镁条与稀盐酸反应生成氯化镁和氢气,反应的化学方程式为:Mg+2HCl═MgCl2+H2↑;该反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应;(4)氨气(NH3)与氧化铜在加热条件下反应生成氮气、一种红色固态物质(铜)和一种无色液态物质(水),反应的化学方程式为:2NH3+3CuO
CaCO3↓+H2O+CO2↑;该反应是吸热反应;(3)镁条与稀盐酸反应生成氯化镁和氢气,反应的化学方程式为:Mg+2HCl═MgCl2+H2↑;该反应是一种单质和一种化合物反应生成另一种单质和另一种化合物的反应,属于置换反应;(4)氨气(NH3)与氧化铜在加热条件下反应生成氮气、一种红色固态物质(铜)和一种无色液态物质(水),反应的化学方程式为:2NH3+3CuO![]() 3Cu+N2+3H2O。
3Cu+N2+3H2O。
首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤(写、配、注、等)进行书写即可。


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】如下图:A是铝在元素周期表中的有关信息,B~E是几种粒子的结构示意图。
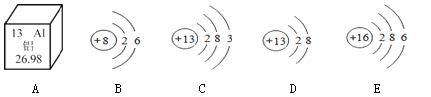
(1)铝元素的相对原子质量为 。
(2)上图中B、C、D、E四种粒子属于 种元素,其中化学性质相似的是 (填字母),D 粒子的化学符号是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A、B、C、D是初中化学常见的物质,能发生如下图所示的转化关系。
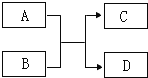
(1)若A是CH4,其燃烧的化学方程式是 ;
(2)若B是一种碱,常用于改良酸性土壤,则A物质可能是 ;
(3)若C、D是盐和水,该反应 (填“是”、“不是”或“不一定是”)中和反应。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是氯化钠、氯化铵和碳酸氢钠三种物质的溶解度曲线,以下说法正确的是
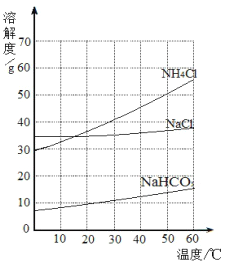
①在20℃时,三种物质的溶液溶质质量分数为NH4Cl>NaCI>NaHCO3
②在20℃时,氯化钠和氯化铵固体各20g分别溶于50g水,所得溶液都是饱和溶液
③等质量的三种物质的饱和溶液从40℃降温到0℃,所得溶液溶质质量分数为NH4CI>NaCI>NaNCO3
④利用结晶法从氯化钠、氯化铵混合物中分离出氯化铵的最佳温度控制在10℃以下
A. ①②③ B. ①③④ C. ①③ D. ②④
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】通过对化学的学习,你已掌握了实验室制取气体的有关规律,请结合下图回答有关问题:
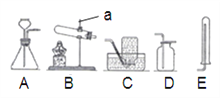
⑴图中标有a的仪器名称是________。
⑵实验室用氯酸钾制取氧气,反应的化学方程式为 _________,欲收集较纯净的氧气,最好选用的收集装置是_____ (填字母,下同),判断氧气已经集满的方法是_____。如用A装置制取氧气,反应的化学方程式是_____。
⑶实验室用锌粒和稀盐酸制取氢气,应选择的装置组合是_____,反应的化学方程式为___。
⑷下面左图是校本课程研究小组在老师指导下改进的电解水的实验装置示意图,下面右图是霍夫曼电解水的实验装置示意图.请据图回答下列问题:
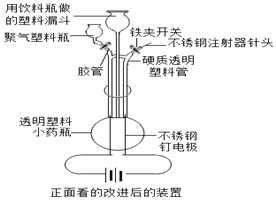

①写出电解水的化学方程式:____________;
②用玻璃三通管将左图装置电解水时产生的气体混合在一起,点燃用该混合气吹出的肥皂泡时的实验现象是:_____;
③左图实验装置的优点是:_____,与右图装置相比,用左图装置进行该实验的主要不足之处是:____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙三种固体物质的溶解度曲线如图所示。请回答:
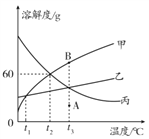
(1)0℃时,三种物质中溶解度最大的是_____ 。
(2)t2℃时,在盛有50g水的烧杯中加入35g甲物质,充分搅拌后所得溶液的质量是____ 。
(3)将甲溶液由A点转变为B点,可采用的方法是_______________(填一种即可)。
(4)如图,将放有固体X的试管放入烧杯中,然后向试管内加入液体Y,一段时间后丙溶液中有固体析出,则对应的X和Y物质是_____。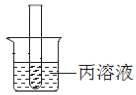
A.氯化钠和水 B.镁条和稀盐酸
C.硝酸铵和水 D.氢氧化钠和水
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(8分)某工厂化验室用质量分数为20%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸。
(1)配制质量分数为20%的氢氧化钠溶液50 g,需要固体氢氧化钠________g和水__________mL。
(2)洗涤一定量石油产品中的残余硫酸,共消耗该氢氧化钠溶液40 g,洗涤后溶液呈中性。求在这一定量的石油产品里H2SO4的质量。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】初中化学中,我们学习了酸和碱发生中和反应的实质是H++OH﹣=H2O.像这种实际参加反应的离子符号来表示反应的式子叫离子方程式.离子方程式的书写一般按以下步骤:(以Na2SO4与BaCl2反应为例)①写出Na2SO4与BaCl2反应的化学方程式:___________; ②把易溶于水的物质写成离子形式,把难溶的物质、气体和水等仍用化学式表示。上述方程式可改写成:2Na﹢+SO42-+Ba++2Cl-=BaSO4↓+2Na﹢+2Cl- ③删去方程式两边不参加反应的离子:Ba2++SO4-═BaSO4↓。 ④检查方程式两边各元素的原子个数和电荷总数是否相等。
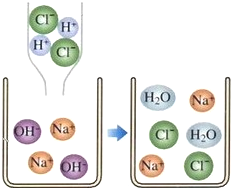
请回答:
(1)下列各组中的离子,能在溶液中大量共存的是________
A、Na+、Mg2+、Cl﹣、SO4 ﹣ B、Na+、H+、Cl﹣、OH﹣
C、Na+、Cu+、Cl﹣、SO42﹣ D、Na+、NH4+、Cl﹣、OH﹣
(2)写出稀盐酸滴在石灰石上所发生反应的离子方程式_________.
(3)写出一个与离子方程式Mg+2H+=Mg2++H2↑相对应的化学方程式________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com