
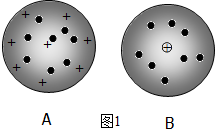
分析 (1)道尔顿认为原子是坚实的、不可再分的实心球,后来汤姆森通过实验发现了电子,他认为原子中存在更小的微粒,原子是可分的,并提出类似“西瓜”的原子模型,认为电子就像“西瓜子”一样镶嵌在带正电荷的“西瓜瓤”中;卢瑟福的原子核式结构模型:在原子的中心有一个很小的核,叫原子核,原子的全部正电荷和几乎全部质量都集中在原子核里,带负电的电子在核外空间里绕着核旋转;
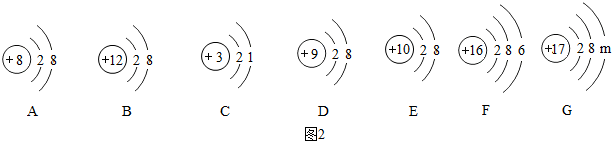
(2)阳离子的核内质子数小于核外电子数;阴离子的核内质子数大于核外电子数;从原子结构示意图进行分析;
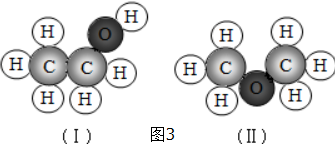
(3)比例模型可以直观地表示分子的形状,其碳原子的成键情况是确定分子结构的关键,碳原子的成键情况主要根据与碳原子形成共价键的原子的数目确定,原子半径的关系为C>O>H
解答 解:(1)①道尔顿认为原子是坚实的、不可再分的实心球,后来汤姆森通过实验发现了电子,他认为原子中存在更小的微粒,原子是可分的,并提出类似“西瓜”的原子模型,认为电子就像“西瓜子”一样镶嵌在带正电荷的“西瓜瓤”中;卢瑟福的原子核式结构模型:原子是一个空心的球,在原子的中心有一个很小的核,叫原子核,原子的全部正电荷和几乎全部质量都集中在原子核里,带负电的电子在核外空间里绕着核旋转.故答案为:A;
②根据汤姆森和卢瑟福理论分析可知,BCDG代表汤姆森的观点;BCEFGH代表卢瑟福的观点,故答案为:BCDG;BCEFGH;
(2)①阳离子的核内质子数小于核外电子数;阴离子的核内质子数大于核外电子数;②从C和F的原子结构看,C易失去一个电子,F易得到两个电子,故它们的化合价分别应该是+1价和-2价;③根据原子结构的表示方法,G的质子数为17,则其有三个电子层,由里向外每层的电子数为2,8,7,故m=7,最外层电子数大于4,易得电子;故答案为:①B;AD;②+1;-2;③7;得到;
(3)CH3-CH2-OH和CH3-O-CH3的化学式相同,但结构不同,不是同种物质;故答案为:相同.
故答案为:(1)①A;②BCDG;BCEFGH;(2)①B;AD;②+1;-2;③7;得到;(3)相同.
点评 本题考查原子、离子、分子的结构知识,基础性强.


 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:初中化学 来源: 题型:解答题
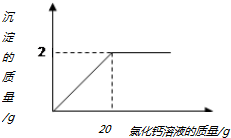 小林在做实验时发现,实验室的纯碱样品中混入了少量的食盐,为测定该纯碱样品中碳酸钠的含量,小明称取该纯碱样品2.5g,再滴加氯化钙溶液至不再产生沉淀,产生沉淀的质量与加入氯化钙溶液的质量关系如图所示
小林在做实验时发现,实验室的纯碱样品中混入了少量的食盐,为测定该纯碱样品中碳酸钠的含量,小明称取该纯碱样品2.5g,再滴加氯化钙溶液至不再产生沉淀,产生沉淀的质量与加入氯化钙溶液的质量关系如图所示查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com