
����Ŀ����ҵ�����������Ѱĸ���Ʒ���������Ʊ���ԭ���۵�������ͼ
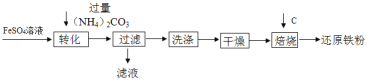
����˵������ȷ����
A. ��ת����ʱ����Һ��������FeCO3�������÷�Ӧ�Ļ�����Ӧ�����Ǹ��ֽⷴӦ��
B. ����������õ�����Һ�е�����ֻ��(NH4)2SO4��
C. ����������������������FeCO3ת��ΪFeOOH��CO2����ʱ��FeCO3��Ӧ��������O2��H2O��
D. ȡ14.06g��ԭ����(������Fe������FexC)���������г�ּ��ȣ��õ�0.22gCO2����ȡ��ͬ�����Ļ�ԭ����������ϡ�����ַ�Ӧ(FexC��ϡ�����Ӧ)���õ�0.48gH2����FexC�Ļ�ѧʽ��Fe3C��
���𰸡�BD
��������
����������̼��立�Ӧ����̼����������������泥�����̼��粒��������˺�õ�����Һ�е�����������狀�̼��泥�ͨ��ϴ�Ӹ��������![]() ת��Ϊ
ת��Ϊ![]() ��
��![]() ��̼��������ת��Ϊ��ԭ�����ۡ�
��̼��������ת��Ϊ��ԭ�����ۡ�
A������������̼��立�Ӧ����̼����������������泥���ת����ʱ����Һ��������![]() ��������Ӧ�������ֻ�����������ɷ֣���÷�Ӧ�Ļ�����Ӧ�����Ǹ��ֽⷴӦ����A��ȷ�����������⣻
��������Ӧ�������ֻ�����������ɷ֣���÷�Ӧ�Ļ�����Ӧ�����Ǹ��ֽⷴӦ����A��ȷ�����������⣻
B������̼��粒��������˺�õ�����Һ�е�����������狀�̼��泥���B����ȷ���������⣻
C�� ����������������������![]() ת��Ϊ
ת��Ϊ![]() ��
��![]() ����ʱ��
����ʱ��![]() ��Ӧ��������
��Ӧ��������![]() ��
��![]() ����C��ȷ�����������⣻
����C��ȷ�����������⣻
D��0.22g������̼������̼Ԫ�ص�����Ϊ![]() ��������0.48g������Ҫ������������Ϊa
��������0.48g������Ҫ������������Ϊa
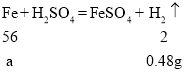
![]()
![]()
��![]() ����Ԫ�ص�����Ϊ
����Ԫ�ص�����Ϊ![]() ��
��![]() ������̼Ԫ�ص�������Ϊ
������̼Ԫ�ص�������Ϊ
![]() ����
����![]() ����
����![]() �Ļ�ѧʽΪ
�Ļ�ѧʽΪ![]() ����D����ȷ���������⡣��ѡBD��
����D����ȷ���������⡣��ѡBD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��A��B��C���ֹ������ʵ��ܽ������ͼ��

��1����ͼ�У�t2��ʱA��B��C�����������ܽ��������__________��P������ʾ�ĺ�����___________��
��2��t2��ʱ������������A��B��C���������ܽ��γɱ�����Һ��������Һ����������__________������A������B������C����
��3������ͼ��ʾ��20��ʱ�����Թܷ���ʢ��X�ı�����Һ���ձ��У����Թ��м��뼸С��þ�����ټ���5mLϡ���ᣬ�����������������ݣ�ͬʱ�ձ��г��ֻ��ǣ���X����ΪA��B��C���ֹ��������е���һ��__________?
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾװ���о�������̼�����ʡ����У��١���Ϊ����ɫʯ����Һ��ʪ�����ڡ���Ϊ��ʯ����ҺȾ����ɫ�ĸ�������
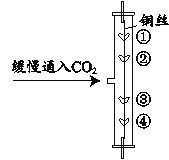
��1��˵��CO2�ܶȴ��ڿ�����ʵ������Ϊ_____������֮�⣬��ʵ�黹���о��Ķ�����̼��������_____��
��2��ijͬѧ������˵������ô������ɺ۲쵽�����ֱ����ɫ�����ǣ�����Ϊ����������˵����̼�����ȷ�����ѧ��Ӧ����������_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС���ͬѧ����ʵ������̽��ijЩ�ᡢ���֮���� �������ֽⷴӦ��
���������ϣ����ᱵ(BaSO4)��ɫ���壬������ˮ��Ҳ�������ᡣ
��ʵ����̽����
���� | ���� | ʵ����� | ���� | |
ʵ��һ |
| ��________ | ��ѧ����ʽ��: K2CO3+H2SO4=K2SO4+H2O+CO2�� | �������� ������� �Т�____ ���г��� ����ʱ, ���ֽⷴ Ӧ���Է� ���� |
ʵ��� | ������ϡ����
| ��Һ��ɫ �ɺ�ɫǡ �ñ�Ϊ�� ɫ |
| |
ʵ���� |
| ������ɫ ���� | �÷�Ӧ��ʵ����:Ba2++SO42-=BaSO4�� |
ʵ����������,ijͬѧ���ں���,��ʵ�����Թ�����ϲ���Һ a ������һ֧�ྻ���Թ���,����Һ a ����εμ� K2CO3 ��Һ���ڵμӹ����У������Ȳ� �����ݣ�Ȼ���ֲ�����ɫ������������������,�����ж�ԭ��Һ a �е���������______��
����չ����ϡ���ᡢCa(OH)2 ��Һ��NaCl ��Һ��Na2CO3 ��Һ����������Һ�� ���,д���ܷ�����Ӧ���г������ɵĻ�ѧ����ʽ______��
����˼�����ֽⷴӦ��ʵ���dz��ŵ�λ�����______���������� ���ƣ���Ŀ��С�ķ�����С�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��F�ֱ��������ֻ�����Ԫ����ɵij��������B������������㷺��һ������������п��������D�㷺���ڲ�������ֽ����֯��ϴ�Ӽ�������������θ���к���F���ɰ�������������֮���һ���ֹ�ϵ��ͼ��ʾ����ͼ����������ʾ���˵������ܷ�����ѧ��Ӧ����������ʾ���ʼ����ת����ϵ�����ַ�Ӧ�������������ȥ����ش��������⣺
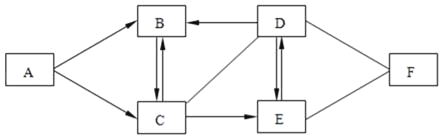
��1��B���ʵĻ�ѧʽΪ_____��F���ʵĻ�ѧʽΪ_____��
��2��C��D��Ӧ�Ļ�����Ӧ������_____
��3��D��E��Ӧ�Ļ�ѧ��Ӧ����ʽΪ_____��
��4��A��C��Ӧ�Ļ�ѧ��Ӧ����ʽΪ_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ���仯�����������������ж��й㷺��Ӧ�á�
һ��ͭ��ұ��
����һ�����Ź����ߴӰ������̴���ͭ��ַ�У����ֵ�ʱұ��ͭ����Ҫ����ԭ���ǿ�ȸʯ[��Ҫ�ɷ��Ǽ�ʯ̼��ͭCu2(OH)2CO3]����Ҫȼ����ľ̿��ұ���¶ȹ�����1000�����ҡ�
���϶���������������������������м��������������Ϊͭ����������������������ͭһ������ʣ�����ȸʯ���������еô���Һ����������Ͷ�����Һ�м��ɵ�ͭ��
(1)�������������Ϳ�ȸʯ��˵���У���ȷ����___��
A ǰ�������Σ����ߵ���Ҫ�ɷ��Ǽ� B ǰ�������ᣬ���ߵ���Ҫ�ɷ��Ǽ�
C ǰ�ߺͺ��ߵ���Ҫ�ɷֶ����������� D ǰ�ߺͺ��ߵ���Ҫ�ɷֶ�������
(2)�Կ�ȸʯΪԭ�ϵ�ұ�������У����ִ���ѧ�Ĺ������ӣ������漰�Ļ�ѧ��Ӧ��__��
��Cu2(OH)2CO3![]() 2CuO+CO2��+H2O ��2CuO+C
2CuO+CO2��+H2O ��2CuO+C![]() 2Cu+CO2��
2Cu+CO2��
��CuO+CO![]() Cu+CO2 ��CO2+C
Cu+CO2 ��CO2+C![]() 2CO
2CO
A �٢� B �٢� C �٢ڢ� D �٢ڢۢ�
(3)��֪��Ԫ�ػ��ϼ����ߺͽ��͵ķ�Ӧ����������ԭ��Ӧ����(2)���ĸ���Ӧ�У����������ֻ�����Ӧ���͵���(����ţ���ͬ)____��������������ԭ��Ӧ����____��
(4)���϶��У������ܽ��ȸʯ������ϡ���ᣬд���ô˷���ұ��ͭ�Ļ�ѧ����ʽ��___��___��
����ͭ���仯�����Ӧ��
(5)��ʽ̼��ͭ��һ�־��й㷺��;�Ļ�����Ʒ����Ҫ���ڹ���ӫ��ۼ������ͭ�ε�����ȡ���ʽ̼��ͭ��Na2CO310H2O��CuSO45H2O��Ӧ�Ʊ���ԭ����2CuSO4+2Na2CO3+H2O=Cu2(OH)2CO3��+2Na2SO4+CO2������ȡ14.0gCuSO45H2O��16.0gNa2CO310H2O�����в��ֱ���ϸ���ٻ����ĥ������������Ӧ������������������һ����ܿ��Ϊ��𤽺״�����������Ѹ��Ͷ��200mL��ˮ�У����ٽ��貢������Դ��������ɫ�������ɣ����ˣ���ˮϴ�ӣ�����Һ�в���SO42��Ϊֹ��ȡ����������ɣ��õ�����ɫ���塣
�ٻ�������Ӧʱ�������������ԭ����___��
�ڳ�����Դ��Ŀ����___��
��ɲⶨ��
��ͬѧ�������Ϸ�����Cu(OH)2CuCO3��ʾ��ʽ̼��ͭ�Dz�ȷ�ģ���Ϊȷ����ѧ�ı���ʽ��mCu(OH)2nCuCO3����ͬ��Դ�ļ�ʽ̼��ͭ��m��nֵ��Ҫ����ⶨ���ȷֽⷨ�ⶨ��ʽ̼��ͭ��ɵ�ʵ��װ������ͼ��ʾ��ͨ���ⶨ��ʽ̼��ͭ�����Ⱥ�������������������Ƶ�����ʽ̼��ͭ��̼��ͭ��������ͭ�ĺ������������m��n�ı�ֵ��
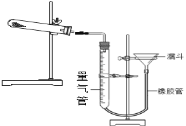
������ƽ��ʵ��ⶨ������±��������Ʒ��m��n��___��������������ʢҺ����ˮ����òⶨֵ������ֵ___(����ƫ��������ƫС������������)��(��֪��״���£�������̼�ܶ�Ϊ1.964g/L)
ʵ����� | ��Ʒ����/g | CO2���/mL (������ɱ�״����) |
1 | 0.542 | 44.82 |
2 | 0.542 | 44.80 |
3 | 0.542 | 44.78 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ�dz��õ��ܼ��������ͼһʵ�������ͼ���ļס����ܽ�����ش��������⣺
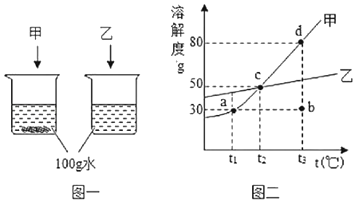
��1��ͼһʵ�飬��̽���ס��ҵ��ܽ��Ե�ͬʱ����x���ס����������ʷֱ�����ˮ�����е������仯�������������ʵ�飬����ʵ�����_____��
��2����t1��ʱ�������ʵ��ܽ����_____g��
��ͼ���У������ʵ�������Һ״̬��a��b��c��d���У����ڲ�����״̬����_____�����ţ���
��t1��ʱ����l5g���뵽_____gˮ�У���ȫ�ܽ��ǡ�õõ�������Һ��Ϊ�˽�һ����߸���Һ�����������������ɽ��еIJ�����_____��
��ȡ�ס��ҵĻ����100g����100g��ˮ������ȴ��t2�棬�����������Ҳ��������������м�������������ȡֵ��Χ��_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2019�������г��л�ѧʵ�鿼�����������ø��������ȡ������(װ��ͼ����)��������ijͬѧ�ڱ���ʵ���������д�IJ���ʵ�鱨�棬��ش��й����⣺
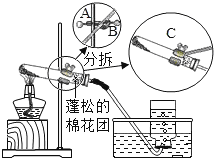
ʵ�鲽�� | �й����� |
�ż�����巢��װ�õ������ԡ� | ���װ�������Եľ�����������������õ��ж�������_____�� |
�����Թ��м�������������ط�ĩ��ʹ��ƽ�����Թܵײ�������ͼ��ʾ��װʵ��װ�á��ڽӽ��Թܿڵĵط�����һС�����ɵ����š� | ����ҩ��ֽ�����Թ��м�������������ط�ĩ�� ����װʵ��װ��ʱ��Ҫ����___�ĸ߶Ƚ�ʢ��ҩƷ���Թ̶ܹ�������̨�ϡ� ��������װ�����Թܵ���б�Ƕȣ�Ӧ����ͼ��A��B��C�ĸ���ť��___��ť�� ���Թܿ����ŵ�������____�� |
ʵ�鲽�� | �й����� |
�Ǽ����Թܣ������ܿ���������������ð��ʱ����ʼ�ռ����塣 | �ټ����Թܵķ�����____�� �ڷ�����Ӧ�Ļ�ѧ����ʽΪ____�� ���ռ���ƿ�����IJ��������ǣ��ȼ���ƿ�е�ˮ�����һֻ�ַ��ȼ���ƿ����һֻ������С�ĵؽ����ܴ�ƿ���ƿ���Ȼ��___�����Ѽ���ƿ�����������ϡ� |
�������ռ���Ϻ���B | ����B����____����_____ |
���ռ����������䴿������ƫ�ͣ���ԭ�������____(����ĸ)��
A ��������л����˶������� B �ռ�ǰ������ƿ��δע��ˮ
C �ռ�����ƿ��������ˮ D δ��������������ð��ʱ�Ϳ�ʼ�ռ�
��ѡ����ˮ���ռ�һƿ������������˿��������ȼ����ʵ��ʹ�õ�������____��
��)����3.16g������ع���һ��ʱ�䣬����������е���Ԫ����1/4ת��Ϊ�����������ɵ�����������Ϊ____��ʣ���������Ԫ�ص���������Ϊ____��(��ȷ��0.1%)
����ͬѧ��ȡһ���������������ȡһ�����������������¶ȿ�����250�������O2��ʵ�����ʱ����ͬѧ�������ø��������ȡ������ʵ���У��ռ�����O2�������۲����������һ����ͬѧ������ʦ��ָ���½���������̽����
��������룩���������غ㶨�ɣ������������²��룺
�����Ӧ���ɵ�MnO2�ֽ�ų�O2
�����Ӧ���ɵ�K2MnO4�ֽ�ų�O2
��ʵ����֤��ͬѧ�Ƿ�Ϊ���飬�ֱ��������ʵ�飺
�ٵ�һ��ͬѧȡһ��������MnO2����250�������¼���һ��ʱ�䣬��ȴ����MnO2���������䡣�����____����
�ڵڶ���ͬѧȡһ��������K2MnO4��250�������¼��ȣ���������____(��������������������)���ó��˲������ȷ�Ľ��ۡ�
��ͬѧ��������òⶨ����Ҳ����֤���ϲ����Ƿ���ȷ����ͬѧѡ���ʵ�鷽��������____��
����չ���죩ʵ�鷢�֣�K2MnO4����ֻ�ܲ��ַֽ⣬������������K2MnO4�ֽ��������K2O����ֽ����Ӱ�졣Ϊ��֤�˽��ۣ��������ʵ�鷽����
�ٷֱ�ȡK2MnO4��������֧�Թ��У�һ֧�Թ��м���K2O��һ֧�Թ��в���K2O��
�ڼ��ȣ�����ͬ���ļ���ƿ������ˮ���ֱ��ռ�һƿ���塣�۱Ƚ����õ�ʱ�䳤�̣���ȷ������صķֽ��Ƿ����������й�ϵ���ù����л����������ͬ�ı�����______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ����Һ����������������ʮ����Ҫ�����á�
��1����ֱ��ˮ�����ɽ�����ˮ����Ϊ����ˮ�����ڲ�ʹ�õĻ���̿��Ҫ��______���á�ʵ���ҳ���______��������ˮ��Ӳ�ȡ�
��2��C1O2������ˮ���õ�����������ȡC1O2�ķ�Ӧ���£�C12+2NaC1O2=2C1O2+2X����X�Ļ�ѧʽΪ______��
��3��ʳ��ˮ�ܵ���������ʳ������ˮ�γ�______��
��4����ͼ�Ǽס������ֲ����ᾧˮ�Ĺ������ʵ��ܽ�����ߡ�
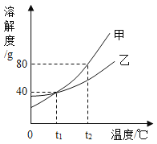
��t1��ʱ�������ʵ��ܽ����_____g��
��t2��ʱ�����Ӽ����������ʵı�����Һ�������������Ĺ��壬���������϶�ˮ����_____ �����������������������ʵı�����Һ��
��t2��ʱ����һƿ������������Ϊ10��������Һ��������60 gˮ����������������Ϊ20%����ԭ��Һ�����ʵ�����Ϊ_____g��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com