
【题目】燃烧是人类利用最早的化学反应之一,但燃烧控制不当会引起火灾。
(1)房屋着火时,用高压水枪灭火,其灭火原理是__________________。
(2)氢氧化铝是一种重要的阻燃剂,其受热分解时吸收大量的热,反应的化学方程式为2Al(OH)3 △ Al2O3+3X,则X的化学式为____________。
 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:初中化学 来源: 题型:
【题目】在化学反应前后,元素化合价发生变化的反应属于氧化还原反应
(1)化合反应可能是氧化还原反应.请举一例说明(用化学方程式表示)。
(2)分解反应可能不是氧化还原反应,请举一例说明(用化学方程式表示)。
(3)置换反应一定是氧化还原反应,请解释原因。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学在学习酸的化学性质后,做了甲、乙二个实验,实验结束后,把甲乙试管中的废液依次缓慢倒入同一洁净的废液缸中,下列对废液缸中废液成分的分析正确的是
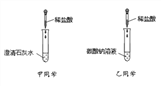
A. 废液中除氯化钠外,一定有氯化钙
B. 如果废液呈碱性,则一定有氢氧化钙
C. 如果废液呈酸性,则一定有氯化钙、氯化钠
D. 废液中一定有氯化钠,还有氢氧化钙或碳酸钠或盐酸中的一种物质
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实践活动课上,小红将家里的彩漂粉(主要成分是过碳酸钠)带到实验室进行探究。她阅读标签并查阅相关资料得知:过碳酸钠是一种白色结晶颗粒,溶于水时,分解生成碳酸钠和过氧化氢。

(1)将过碳酸钠加入水中溶解后,取少量溶液于试管中,加入二氧化锰,观察到有大量气泡产生,检验生成的气体的操作为________。
(2)欲证明过碳酸钠溶于水后有碳酸钠生成,选用的试剂为_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】以下两组实验都采用了对比的方法。
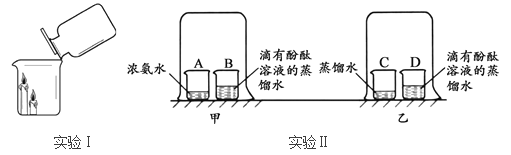
(1)实验Ⅰ,将二氧化碳倒入烧杯中,观察到的现象是___________________,说明二氧化碳具有的性质是______________________________________________。
(2)实验Ⅱ,通过甲、乙对比可得出的结论是____________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A、B、C、D是初中化学常见的物质。已知B是相对分子质量最小的氧化物,D是植物光合作用的原料之一。右图为它们之间的转化关系,请回答下列问题:
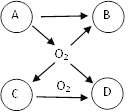
(1)物质C的化学式为__________;
(2)A转化为O2的化学方程式为__________;
(3)实验室制取D的化学方程式为__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用氯酸钾和二氧化锰的混合物制取氧气,固体混合物的质量随加热时间的变化如下图所示。下列分析错误的是
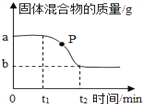
A. 反应结束时能生成(a-b)g氧气
B. 在0~t1时段,因MnO2未起作用,所以反应未开始
C. P点处固体的成分是氯酸钾和氯化钾
D. 在t1~t2时段,固体中氯元素的质量分数不断增大
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】科学探究是学生积极主动获取化学知识、认识和解决化学问题的重要实践活动。下面呈现的是某实验小组在课堂上做的一组探究实验:
(1)在a试管中加入约2mL硫酸铜溶液,然后滴入几滴氢氧化钠溶液,观察到的现象是______。
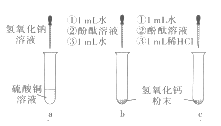
(2)向b、c两支试管中各加入相同质量的氢氧化钙粉末(用药匙的柄把一端挑一点),然后各加入1mL水,振荡,呈浑浊状,静置,再各滴人1~2 滴酚酞溶液,观察到两试管溶液均变红。继续向b试管中加入约1mL水,振荡;向c试管中加人约1mL稀盐酸,振荡。发现b试管变澄清,溶液仍呈红色,c试管变澄清,溶液变成无色。根据上述实验可验证氢氧化钙的哪些性质_______(写出一点即可),向b试管中第二次加入约1mL水的作用是______。
【提出问题】试管c中加入约1mL稀盐酸后,溶液中的溶质是什么?
【查阅资料】查阅资料:CaCl2溶液呈中性。
【猜想假设】小丽猜想:I.CaCl2Ⅱ.CaCl2和HClⅢ.CaCl2和Ca(OH)2
【反思质疑】小明对猜想_______产生质疑,理由是_______
【进行实验】小组同学通过交流,设计如下实验方案进行验证:
实验步骤 | 实验现象 | 实验结论 |
取少量c试管中的溶液于试管中,______________ | ________ | 猜想Ⅱ成立 |
实验结束,小组同学将a、b、c三支试管中的剩余物质混合,发现废液呈浑浊。
【问题与交流】废液中大量存在的阳离子有_______。写出废液中可能发生反应的一个化学方程式_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】Ⅰ下面是某工厂苛化法生产烧碱的示意图。请回答下列问题:
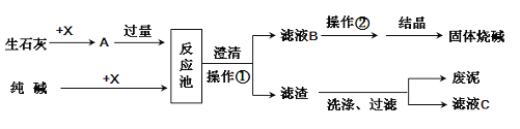
(1)X的化学式________。
(2)生石灰可以由__________(填名称)高温煅烧而得,其反应的化学方程式为:________________。
(3)操作②的名称是_________;结晶得到的固体烧碱中可能含有少量的__________(写化学式);烧碱有强烈的腐蚀性,如果不慎将碱液沾到皮肤上,可先用较多的水冲洗,再涂上稀_________溶液。
(4)滤液C可加入反应池循环再利用,目的是降低生产成本和防止__________。
(5)操作①需要的玻璃仪器有漏斗、玻璃棒________,其中玻璃棒的作用为_________________
Ⅱ.我国制碱工业的先驱侯德榜将制碱与制氨结合起来的联合制碱法,为纯碱和氮肥工业技术的发展做出了杰出的贡献。其生产工艺流程示意图如下:
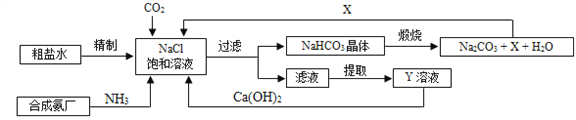
⑴粗盐水中主要含有Ca2+、Mg2+、SO42-等杂质离子,工业上常用加入稍过量的NaOH溶液、Na2CO3溶液、BaCl2溶液及适量的盐酸等除杂、精制。则加入试剂合理的顺序为_______、盐酸(写序号,只写一种)。加盐酸的作用是(用化学方程式表示)_______________、_______________。
(2)X的化学式为_______。
(3)Y是滤液中最主要成分,Y与Ca(OH)2反应的产物之一可用于循环使用,该产物的名称为_______,写出Y的一种用途_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com