
【题目】在一密闭的容器中,一定质量的木炭与过量的氧气在点燃的条件下充分反应,容器内各相关量与反应时间的对应关系正确的是( )
A.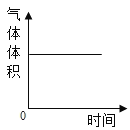 B.
B.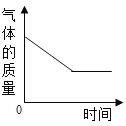 C.
C. D.
D.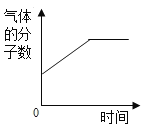
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】原子结构与元素的性质和物质的组成密切相关,请将答案填写在下面的横线上:
(1)镁原子的结构示意图为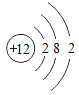 ,其在化学反应中易_________(填“得到”或“失去”)电子,其离子符号是___________。
,其在化学反应中易_________(填“得到”或“失去”)电子,其离子符号是___________。
(2)钠元素与氯元素组成的化合物是_________(化学式),构成该物质的微粒是_______(选填“分子”、“原子”、或“离子”);
(3)与元素化学性质关系最密切的是_________(填字母编号);
A 元素的相对原子质量 B 元素的核电荷数
C 原子的核外电子数 D 原子的最外层电子数
(4)金刚石、石墨都是由碳元素组成,它们的化学性质相似,物理性质却有很大差异。其原因是_______(填字母编号)。
A 构成它们的原子大小不同 B 构成它们的原子数目不同
C 金刚石、石墨由不同种原子组成 D 金刚石、石墨里碳原子排列方式不同
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某研究性学习小组设计了测定纯碱样品(只含NaCl杂质)中碳酸钠质量分数的实验方案。请回答下列问题:
(1)碳酸根离子沉淀法。实验步骤:
①用托盘天平称取样品wg放入烧杯中加水溶解;
②加入足量BaCl2溶液充分反应。证明反应后BaCl2剩余的方法是_____;
③过滤、洗涤、干燥、称量沉淀的质量为mg;
④计算出碳酸钠的质量,再计算样品中碳酸钠的质量分数。
(2)指示剂变色法。实验步骤:
①用托盘天平称取样品10.6g放入烧杯中加水溶解;
②滴入几滴酚酞溶液;
③用滴管慢慢滴入10%的稀盐酸,并不断搅拌,至溶液颜色恰好变为无色为止,共用去了稀盐酸7.3g。请回答:
a.酚酞溶液的作用是_____;
b.边滴加稀盐酸,边要用玻璃棒不断搅拌的目的是_____。
c.反应的化学方程式为_____,10.6g样品中含碳酸钠的质量为_____,样品中碳酸钠质量分数为_____(用百分数表示)。
(3)测氯化钠法。请你完成下列实验方案:
①取一些样品放入烧杯中加水溶解:
②加入足量稀硝酸,再加入足量的硝酸银溶液;加入硝酸银溶液时发生反应的化学方程式是:_____。
③过滤、洗涤、干燥、称量沉淀的质量为mg;
④计算出氯化钠的质量,再求样品中碳酸钠的质量分数。但实验后有同学发现,按上述操作步骤是不能计算出碳酸钠的质量分数,原因是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用下图装置进行实验。升温至60℃的过程中,仅①燃烧;继续升温至260℃的过程中,仅③燃烧。下列分析不正确的是( )
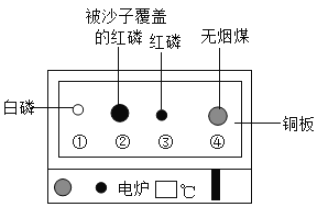
A. ①燃烧,说明白磷是可燃物
B. 对比①③,可说明红磷的着火点比白磷的高
C. 对比②③,可验证燃烧需可燃物与氧气接触
D. ④未燃烧,说明无烟煤不是可燃物
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“水”在化学实验室中是经常用到的一种试剂,以下图示实验中都用到了水。
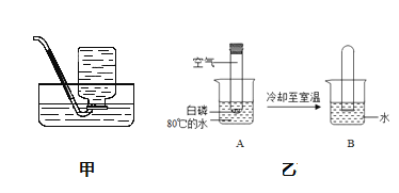
(1)如图甲,用此装置收集氧气前要将集气瓶中灌满水,其目的是____。
(2)如图乙装置可用来测定空气中氧气的含量。实验进行到“B”环节可看到的现象是___;A烧杯中“80℃热水”的作用是____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室用碳酸钠溶液与氯化钙溶液反应制取高纯度碳酸钙粉末,烧杯中现有100g碳酸钠溶液,将160g氯化钙溶液分四次加入,充分反应,四次测量所得数据如表所示:
次数 | 加入氯化钙溶液的质量/g | 烧杯中溶液的总质量/g |
一 | 40 | 134 |
二 | 80 | 168 |
三 | 120 | 202 |
四 | 160 | 242 |
(1)恰好完全反应时,生成沉淀的总质量为_____g。
(2)计算氯化钙溶液的溶质质量分数_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】学会溶液的准确配制和分离提纯在实际应用中有重要意义。
(1)用氯化钠固体配制50g质量分数为6%的氯化钠溶液,需要氯化钠_____g,水_____g。
(2)若用己配好的质量分数为6%的氯化钠溶液配制50g质量分数为3%的氯化钠溶液,则需要6%的氯化钠溶液_____g;水_____g。
(3)海水晒盐可得到粗盐,粗盐中含有较多杂质,可通过_____方法除去泥沙。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵:
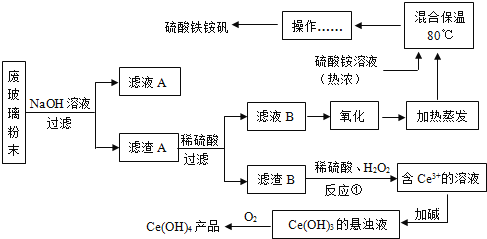
已知:1.SiO2+2NaOH=Na2SiO3+H2O
2.CeO2是一种金属氧化物,化学性质稳定,与稀硫酸不反应。在H2O2存在的条件下,两种物质能反应。
3.硫酸铁铵矾[Fe2(SO4)32(NH4)2SO43H2O]广泛用于水的净化处理.
(1)氧化铈(CeO2)中,铈的化合价为____________,检验硫酸铁铵溶液中含有NH4+的方法是:__________。
(2)为提高①中硫酸的反应效率,可采用的具体措施有_____________。(写一种即可)。
(3)操作应为_____________。
(4)反应①之前先要洗涤滤渣B,其目的是为了除去_____________(填离子符号)。
(5)请补充完整①反应的化学方程式:2CeO2+3H2SO4+H2O2=Ce2(SO4)3+_____+ ____↑。
(6)碲(Te)被誉为“现代工业、国防与尖端技术的维生素,创造人间奇迹的桥梁”。实验室模拟提取碲的一个实验是:取某含碲溶液于烧瓶中,加入适量的NaCl,加热到一定温度,持续通入SO2,待反应一段时间,过滤得到粗碲。反应方程式为TeOSO4 +2SO2+3H2O![]() Te↓+ 3H2SO4,为探究获得较高粗碲沉淀率的反应条件,某研究小组在控制NaCl浓度和SO2流量不变的条件下,进行下述对比实验,数据如下:
Te↓+ 3H2SO4,为探究获得较高粗碲沉淀率的反应条件,某研究小组在控制NaCl浓度和SO2流量不变的条件下,进行下述对比实验,数据如下:
实验 | 温度/℃ | 反应时间 | 粗碲沉淀率/% |
a | 65 | 3.0 | 65.0 |
b | 80 | 3.0 | 98.9 |
c | 80 | 2.0 | 98.9 |
d | 90 | 2.0 | 97.0 |
① a和b的结论是______________。
②为了提升设备利用效率和节约能源,可进一步优化反应条件测定粗确沉淀率。若再设计对比实验,选择的反应条件还可以是_________。
A80℃,1.5h B80℃,2.5h C70℃,
查看答案和解析>>
科目:初中化学 来源: 题型:
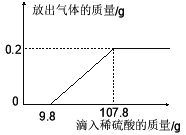
【题目】在烧杯中加入2.14g久置的铝箔,再滴加稀硫酸,放出气体的质量与所加稀硫酸质量的关系如右图所示。请回答下列问题:
(1)产生氢气 g,刚开始滴加稀硫酸没有氢气放出的原因是 。
(2)所滴加的稀硫酸中溶质的质量分数。
(3)铝箔中铝元素的质量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com