
【题目】铜片在潮湿的空气中久置,表面会产生绿色的铜锈。某小组同学设计并进行
实验,探究铜生锈的条件。
![]()
【猜想与假设】常温下,铜生锈可能与O2、CO2、水蒸气有关。
【进行实验】通过控制与铜片接触的物质,利用右图装置(铜片长
8cm,宽1cm,试管容积为20mL),分别进行下列7个实验,并持续观察30天。
编号 | 主要实验操作 | 实验现象 |
1 | 充满纯净的O2 | 铜片均无明显变化 |
2 | 充满纯净的CO2 | |
3 | 充满经煮沸并迅速冷却的蒸馏水 | |
4 | 加入蒸馏水5mL(液面未浸没铜片),再充满O2 | |
5 | 加入经煮沸并迅速冷却的蒸馏水5 mL,再充满CO2 | |
6 | 充入10mL O2,再充入10mLCO2 | |
7 | 加入蒸馏水5ml,再依次充入10mL CO2和10mL O2 | 铜片生锈,且水面附近锈蚀最严重 |
【解释与结论】
(1)实验3中,要使用经煮沸并迅速冷却的蒸馏水,原因是_______。
(2)实验5的目的是_______。
(3)通过上述实验,得出铜生锈的条件是_______。
【反思与评价】
(4)请写出一种防止铜制品锈蚀的方法_______。
(5)查阅资料可知,铜锈的主要成分是碱式碳酸铜,化学式为Cu2(OH)2CO3。由此,你认为上述实验中只需进行实验(填实验编号),就可探究出铜生锈条件,理由是_______。
(6)与以上进行的实验对比,你认为铜片在通常状况的空气中,生锈非常缓慢的原因
可能是_______。
【答案】 除去水中溶解的氧气 探究铜生锈是否是H2O与CO2共同作用的结果(其他答案合理给分) 需O2、CO2、水蒸气同时存在 涂油 5和7碱式碳酸铜的化学式中含有碳、氢元素,由元素守恒可知,铜生锈的过程中一定有CO2与H2O参加反应,故只需要进行实验5和7即可知道铜生锈条件是否需要O2的参加 空气中O2、CO2、水蒸气的含量较低
【解析】(1)实验3中,气体的溶解度对温度的升高而减小,所以煮沸能除掉水中的氧气,经煮沸并迅速冷却的蒸馏水,是没有溶解氧气的水。(2)加入经煮沸并迅速冷却的蒸馏水5 mL,再充满CO2,该条件下铜不生锈,说明铜、H2O与CO2共同作用下,铜不会生锈;(3)通过上述实验可知,当氧气、水、二氧化碳中缺少任何一种物质时铜不生锈,但氧气、水、二氧化碳、铜并存时,铜能生锈,得出铜生锈的条件是氧气、水、二氧化碳、铜共存。(4)根据铜生锈的条件可知,防止铜制品锈蚀的方法:保持干燥、或隔绝氧气或二氧化碳,(5).碱式碳酸铜的化学式中含有碳、氢元素,由质量守恒定律可知,化学反应前后元素的种类不变,空气中含碳元素的物质为二氧化碳,含氢元素的物质为水,铜生锈的过程中一定有CO2与H2O参加反应,故只需要进行实验5和7即可知道铜生锈条件是否需要O2的参加 ;(6)反应物的浓度会影响反应速率,一般浓度越大,反应速率越快,反之浓度越小,反应越慢,与以上进行的实验对比,你认为铜片在通常状况的空气中,生锈非常缓慢的原因可能是空气中O2、CO2、水蒸气的含量较低。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
【题目】向含CuCl2和HCl的100 g混合溶液中,逐滴加入溶质质量分数为10%的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图,仅考虑沉淀为Cu(OH)2。则下列说法正确的是 ( )
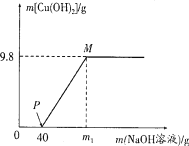
A. 整个反应过程中,溶液中氯离子个数不变
B. PM段的溶液中加入铁粉,会产生气泡
C. M点溶液中氯化钠的质量分数为8.3%
D. 沉淀完全时,m1的数值为80
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】医学中常用溶质的质量分数为0.9%的氯化钠溶液来供给电解质和维持体液的张力。现配制1000g溶质的质量分数为0.9%的氯化钠溶液,实验操作如下:
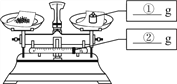
(1)称量氯化钠质量:在下图中分别标出所选砝码的质量和游码的示数。_______、_______

(2)量取水的体积:用量筒量取 _______mL水(ρ水≈1 g/cm3)。
(3)溶解时用到烧杯和玻璃棒,玻璃棒的作用是_______。
(4)装瓶、贴标签:在下图的标签中填上相应的内容_______。

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业上,通过如下转化可制得KClO3晶体。

(1)KClO3中氯元素的化合价为_______。
(2)生产中所用NaCl溶液由粗盐水精制而成,精制时除去粗盐水中泥沙,采用的操作是_______。
(3)完善Ⅰ中反应的化学方程式:NaCl+3H2O=NaClO3 +3_______
(4)已知NaClO3+KCl=NaCl+KClO3,Ⅱ中析出晶体后的滤液是KClO3的_______(填“饱和溶液”或“不饱和溶液”)。
(5)上述流程中,可循环利用的物质是_______
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】超细的铁微粒是一种纳米颗粒型材料,可在低温下将CO2分解为炭.下列推测不合理的( )
A. 超细铁微粒在反应中可能做催化剂
B. 该反应有助于减少温室气体排放
C. 该反应的另一产物可能是O2
D. 该反应属于化合反应
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是甲、乙、丙三种物质(均不含结晶水)的溶解度曲线。现有t2℃时甲、 乙、丙三种物质的饱和溶液(无固体存在)。 下列说法正确的是

A.三种物质溶解度大小依次为:乙>丙>甲
B.将温度由t2℃降到t1℃时,析出甲的质量比乙多
C.若甲中含有少量杂质乙,可采用降温结晶的方法进行提纯
D.将温度由t2℃降到t1℃,所得溶液中溶质的质量分数由大到小的顺序为:乙>丙=甲
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在一烧杯中盛有42.2gCaCO3和CaCl2的粉末状混合物,向其中264.6g水,使混合物中的可溶物完全溶解。然后再向其中逐滴加如溶质的质量分数为10%的稀盐酸,烧杯中难溶固体物质的质量与所滴入稀盐酸的质量关系曲线如图所示。请根据题意回答下列问题:

⑴在滴入稀盐酸的过程中,观察到的明显现象是:
①_______________________
②_______________________
⑵当滴入10%的稀盐酸至图中A点时,烧杯中溶液里含有的溶质是(写化学式)______________。
⑶当滴入10%的稀盐酸146g时(即B点),试通过计算,求此时烧杯中所得不饱和溶液的溶质质量分数。______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com