
 红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如下图所示.同学们对一包久置的“504双吸剂”固体样品很好奇,
红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如下图所示.同学们对一包久置的“504双吸剂”固体样品很好奇,| 实验操作 | 实验现象 | 实验结论 |
| (1)取少量固体放于试管中,加足量蒸馏水溶解,静置后取上层清液滴加无色酚酞溶液 | 固体溶解时试管外壁发烫,试管底部有不溶物,溶液变红. | 固体中一定含有 CaO和氢氧化钙 |
| (2)另取少量固体放于试管中,滴加足量的稀盐酸. | 固体逐渐消失,有大量无色气体产生,得到浅绿色溶液. | 固体中一定含有Fe, 一定不含Fe2O3 |
| (3)将步骤(2)中产生的气体通入到澄清的石灰水中 | 澄清的石灰水变浑浊 | 固体中一定含有CaCO3 |

分析 【作出猜想】本题探究了防腐剂的成分,双吸剂中含有生石灰,氧化钙久置能与水反应生成氢氧化钙,根据书写方程式的原则书写方程式.
【实验探究1】固体溶解时放出大量热,因为生石灰溶于水生成熟石灰放出大量的热,由此可以判断固体中一定含有氧化钙;但氧化钙与水反应生成的氢氧化钙也能使无色酚酞变红,不能确定原固体中是否含有氢氧化钙.取少量固体放于试管中,滴加足量的稀盐酸,固体逐渐消失,有大量无色气体产生,得到浅绿色溶液,固体中一定含有铁,不一定不含Fe2O3理由是:氧化铁和盐酸反应生成氯化铁,铁和氯化铁反应生成氯化亚铁,溶液也是浅绿色.将生成的气体通入澄清石灰水,澄清石灰水变浑浊,说明固体中一定含有CaCO3.
【实验探究2】
由乙丙同学的设计方案可知:磁铁吸引了铁粉,②中滤液A中的氢氧化钙和碳酸钠反应生成碳酸钙白色沉淀和氢氧化钠;取滤渣B于试管中,加入适量稀盐酸,有气泡冒出,溶液变为黄色,说明含有碳酸钙和氧化铁.仍有一种物质氢氧化钙不能确定,因此经过实验测得上述残留固体中含钙物质的总质量为1.6g,而滤渣B中CaCO3的质量为1.0g,故氧化钙或氢氧化钙或两者混合物质量为0.6g,与碳酸钠反应生成的滤渣C碳酸钙的质量为1.0g,C中钙元素质量是:1.0g×$\frac{40}{100}$×100%=0.4g,根据反应前后钙元素守恒,假设0.6g全是氧化钙,则含钙元素质量为0.6g×$\frac{40}{56}$×100%=0.428g,假设全是氢氧化钙,则钙元素质量为0.6×$\frac{40}{74}$×100%=0.324g,而C中钙元素质量为0.4g,因此是氧化钙和氢氧化钙的混合物,即久置固体的成分是:Fe、Fe2O3、CaO、Ca(OH)2、CaCO3.
解答 解:【作出猜想】氧化钙在空气中能与空气中的水反应生成氢氧化钙,化学方程式为CaO+H2O=Ca(OH)2
【实验探究1】甲同学的方案:
(1)取少量固体放于试管中,加足量蒸馏水溶解,静置后取上层清液滴加无色酚酞溶液,固体溶解时试管外壁发烫,说明一定含有氧化钙,氧化钙溶于水放出大量的热,试管底部有不容物,溶液变红,不一定含有氢氧化钙,因为氧化钙和水反应生成氢氧化钙,也能使酚酞试液变红;
(2)另取少量固体放于试管中,滴加足量的稀盐酸,有大量无色气体产生,得到浅绿色溶液,固体中一定含有铁,不一定不含Fe2O3,因为氧化铁和盐酸反应生成氯化铁,铁和氯化铁反应生成氯化亚铁,溶液也是浅绿色.
(3)将步骤(2)中产生的气体通入到澄清的石灰水中,石灰水变浑浊,说明固体中一定含有碳酸钙,碳酸钙与盐酸反应产生二氧化碳使石灰水变浑浊.
【实验探究2】
(1)由乙丙同学的设计方案可知:磁铁吸引了铁粉;固体溶于水后,滤液A中的氢氧化钙和碳酸钠反应生成碳酸钙白色沉淀和氢氧化钠,化学方程式为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
(2)对滤渣B的探究:①取滤渣B于试管中,加入足量稀盐酸,有气泡冒出,溶液变为黄色,说明一定含有碳酸钙和氧化铁,碳酸钙与盐酸反应产生气泡,氧化铁与盐酸反应产生氯化铁溶于水呈黄色.
由乙丙同学的实验还不能确定一定含有氢氧化钙,因为氧化钙与水反应生成了氢氧化钙.
【实验结论】经过实验测得上述残留固体中含钙物质的总质量为1.6g,而滤渣B中CaCO3的质量为1.0g,故氧化钙或氢氧化钙或两者混合物质量为0.6g,与碳酸钠反应生成的滤渣C碳酸钙的质量为1.0g,C中钙元素质量是:1.0g×$\frac{40}{100}$×100%=0.4g,根据反应前后钙元素守恒,假设0.6g全是氧化钙,则含钙元素质量为0.6g×$\frac{40}{56}$×100%=0.428g,假设全是氢氧化钙,则钙元素质量为0.6×$\frac{40}{74}$×100%=0.324g,而C中钙元素质量为0.4g,因此是氧化钙和氢氧化钙的混合物,即久置固体的成分是:Fe、Fe2O3、CaO、Ca(OH)2、CaCO3.
故答案为:【作出猜想】CaO+H2O=Ca(OH)2
【实验探究1】CaO 稀盐酸 Fe 澄清的石灰水变浑浊
【实验分析】(1)氧化钙与水反应生成的氢氧化钙也能使无色酚酞变红,不能确定原固体中是否含有氢氧化钙
(2)氧化铁和盐酸反应生成氯化铁,铁和氯化铁反应生成氯化亚铁,溶液也是浅绿色
【实验探究2】(1)Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
(2)Fe2O3;Ca(OH)2
【实验结论】Fe、Fe2O3、CaO、Ca(OH)2、CaCO3.
点评 有关实验方案的设计和对实验方案的评价是中考的热点之一,设计实验方案时,要注意用最少的药品和最简单的方法;关于对实验设计方案的评价,要在两个方面考虑,一是方案是否可行,能否达到实验目的;二是设计的方法进行比较,那种方法更简便.本考点主要出现在实验题中.


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:初中化学 来源: 题型:解答题
| 物质的质量 | |
| 反应前:烧杯+盐酸 | 22g |
| 10片钙片 | 8g |
| 反应后:烧杯+剩余物 | 27.8g |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 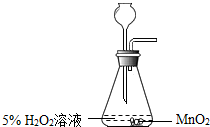 用H2O2溶液和MnO2制氧气 | B. | 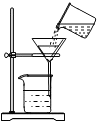 除去混在食盐溶液中的少量泥沙 | ||
| C. | 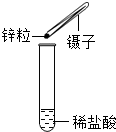 向盛有稀盐酸的试管中加入锌粒 | D. | 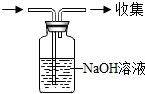 除去混在CO中的少量CO2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
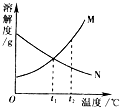 如图表示M、N两种不含结晶水的固体物质的溶解度曲线.根据图示判断,下列说法中,正确的是②
如图表示M、N两种不含结晶水的固体物质的溶解度曲线.根据图示判断,下列说法中,正确的是②查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com