
【题目】下图中的①、②是氟元素、钙元素在元素周期表中的信息,A、B、C、D是四种粒子的结构示意图。请你回答:
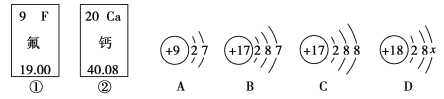
(1)氟元素的相对原子质量为____________,钙元素的原子序数为________;
(2)C粒子属于_______(填“原子”“阳离子”或“阴离子”);若D为原子,x=_______;
(3)A、B、C、D中属于同种元素的粒子是________(填序号,下同);
(4)A粒子的化学性质与B、C、D中哪一种粒子的化学性质相似________。
科目:初中化学 来源: 题型:
【题目】下表是元素周期表的一部分。请完成以下填空:

(1) 从表中查出氟元素的相对原子质量为____________,氯元素的原子序数为_____________。
(2) 地壳中含量最多的元素是_______(填元素名称),它最外层电子数为______________,
在化学反应中易_______(填“得到”或“失去”)电子,形成的离子符号为___________。
(3) 某元素在人体内99%存在于骨骼和牙齿中。该元素的原子结构示意图如下图:
![]()
则该元素的质子数x为_______,形成的离子符号为___________,该离子核外有______个电子层,属于_________元素(填“金属”或“非金属”)。
(4) 元素周期表中同一横行元素的排列规律是:从左到右__________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学利用燃磷法测定空气中氧气含量,实验过程如图所示:

(1)用图1实验测得氧气的体积分数,若该实验没有达到实验目的,可能的原因之一是_________。
(2)图1燃烧结束时,试管里剩余气体主要是______(填化学式),根据实验该气体具有的化学性质是_______(答一点即可)
(3)图1实验代替课本实验图2的优点是_____________ 。(答一点即可)
(4)已知金属镁在空气中燃烧,可分别与氧气与氮气反应,都生成固体物质,该实验中的红磷___________(填 “能”获“不能”)用镁来代替。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小芳发现,氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:
(提出猜想)除二氧化锰、氧化铜外,氧化铁也可以作氯酸钾分解的催化剂。
(完成实验)按下表进行实验:测定分解温度(分解温度越低,催化效果越好)。
实验编号 | 实验药品 | 分解温度 |
① | 氯酸钾 | 580℃ |
② | 氯酸钾、二氧化锰(质量比 1:1) | 350℃ |
③ | 氯酸钾、氧化铜(质量比 l:1) | 370℃ |
④ | 氯酸钾、氧化铁(质量比 1:1) | 390℃ |
(分析数据、得出结论)
(1)由实验_____对比,证明猜想合理;
(2)实验所用的三种金属氧化物,催化效果最好的是_____。
(3)若氧化铁是该反应的催化剂,请写出这个反应的化学方程式__________________。
(4)如表是二氧化锰用量与一定质量氯酸钾制取氧气反应速率关系的实验数据。
二氧化锰与氯酸钾的质量比 | 1/40 | 1/20 | 1/10 | 1/5 | 1/3 | 1/2 | 2/3 | 1/1 | 2/1 |
生成1L氧气所需时间(s0 | 124 | 79 | 50 | 54 | 75 | 93 | 106 | 153 | 240 |
①据如表可知二氧化锰与氯酸钾的质量比为_____时,反应速率最快;
②通过分析可知,在化学反应中催化剂的用量_____越多越好。(填“是”或“不是”)
③二氧化锰用量过多冲淡了氯酸钾粉末,相当于减少反应物的_________,所以反应速率受到影响。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】对乙酰氨基苯酚(C8H9NO2)是速效感冒胶囊的有效成分之一。下列叙述正确的是( )
A. 对乙酰氨基苯酚的相对分子质量是141
B. 对乙酰氨基苯酚中含有2个氧原子
C. 对乙酰氨基苯酚中碳元素的质量分数最大
D. 对乙酰氨基苯酚中,碳、氢、氮、氧元素的质量比是8∶9∶1∶2
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据如图回答下列问题:

(1)写出图中仪器①的名称_________.
(2)实验室准备用氯酸钾制取比较纯净的氧气,采用的装置组合是_________,该反应的化学方程式为____________.
(3)实验室制取二氧化碳的化学方程式为_________,收集装置______,如何验满? _______
(4)氨气是无色、有刺激性气味、极易溶于水的气体,实验室常用加热氯化铵和熟石灰固体混合物的方法制取氨气,则实验室制取并收集氨气的最佳装置组合是_____.(填字母)
(5)某化学兴趣小组进行如下组合实验,对二氧化碳的性质进行验证。

当打开A装置中的分液漏斗活塞后,回答下列问题。
①A中发生反应的化学方程式为_________。
②B中白磷能够燃烧的原因是____________。
③G烧杯中现象说明二氧化碳具有的物理性质是__________ 。
④E处使紫色石蕊变成红色的物质的化学式_________;写出F处发生变化的化学方程式________
(6)小海用如图G装置验证二氧化碳与水的反应,为说明使石蕊变色的物质是碳酸而不是水或二氧化碳,应该采取的实验操作顺序是_______(填序号,可重复选用).
①从b端通氮气 ②将用石蕊溶液染成紫色的干燥纸花放入广口瓶中
③从a端通二氧化碳 ④从分液漏斗中滴加适量水.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学考察了一家化工厂的污水处理情况,结果测得污水水样的pH=3.取一定量的污水用2%的氢氧化钠溶液中和至pH=7(已知污水中其他成分不与氢氧化钠反应),消耗氢氧化钠溶液质量为40g,反应后的溶液质量为113g。
(1)污水水样显_____性(填“酸”、“碱”或“中”)。
(2)若污水中的污染物是盐酸,求污水中HCl的质量分数_______。
(3)若污水中的污染物是硫酸,求至pH=7时,所得溶液溶质的质量分数______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属是现代生活和工业生产中应用极为普遍的一类材料。
(一)已知在相同的条件下,金属的活动性越强,金属和酸反应产生气泡(氢气)的速度就越快。Al、Cu、Fe三种金属在稀盐酸里的反应现象如图1所示。

(1)图1中Y所代表的金属是_____(填“Cu”或“Fe”);
(2)Al、Cu、Fe三种金属的活动性由强到弱的顺序为_____;
(3)铝是一种活泼金属,但常温下铝却有较强的抗腐蚀性,其原因是_____;(用方程式表示化学原理)
(二)防止金属腐蚀,特别是钢铁的锈蚀是世界科学研究和技术领域中的重大问题。铁生锈的条件为铁与_____、_____ 同时接触,_____(举一例物质)可加速铁的锈蚀。为了防止铁制品生锈,应采取的措施是_____(写出一种)。
(查阅资料)铁锈成分复杂,化学式可简单表示为Fe2O3nH2O.浓硫酸可以吸水,碱石灰可以吸收水和二氧化碳。
(提出问题)铁锈(Fe2O3nH2O)中n的值等于多少呢?
(问题探究)小明发现实验室中有一保管不善的铁粉,大部分已经结块成红褐色,为了探究铁锈(Fe2O3nH2O)的组成,称取27.0g这种铁粉样品,按如图2所示装置进行实验。

(4)实验前应先______。
(5)为了保证实验安全,实验开始时应先_____,目的是_____。
(6)A中的现象是_____,请指出该装置中有一处明显不足_____。
(数据处理)图3是加热时间和A中固体质量关系图象,下表是B、C中质量不再变化时B中浓硫酸、C中碱石灰装置质量变化情况。

反应前(g) | 反应后(g) | |
B | 100 | 105.4 |
C | 150 | 163.2 |
(7)写出T3﹣T4时间段发生反应的化学方程式________。
(8)计算原样品中单质铁的质量分数是______。(计算结果保留1位小数)
(9)n的值是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学用微型实验装置(如图)制取二氧化碳并检验其性质,回答问题。
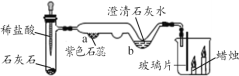
(1)试管中发生反应的化学方程式是______。
(2)b处出现的现象是_________。
(3)根据烧杯中的变化现象,得出二氧化碳的化学性质是______。
(4)另一同学操作时,误将浓盐酸当作稀盐酸使用,结果______处没有明显现象。
(5)你认为微型实验的优点是____(写一条即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com