
【题目】据科学家预测,月球的土壤中吸附着百万吨的氦(He-3),其原子核中质子数为2、中子数为l,每百吨氦(He-3)核聚变所释放出的能量相当于目前人类一年消耗的能量.下列关于氦原子(He-3)的说法正确的是( )
A. 原子核外电子数为1 B. 相对原子质量为2
C. 原子结构示意图为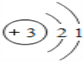 D. 原子结构示意图为
D. 原子结构示意图为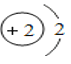
【答案】D
【解析】A、原子中,质子数=核外电子数,故氦原子核外电子数为2,故A错误; B、相对原子质量≈质子数+中子数,故氦的相对原子质量为3,故B错误;C、原子结构示意图中圆圈表示原子核,圆圈内的数字核电荷数,弧线表示电子层,弧线上的数字表示电子层 电子数,氦的核电荷数=质子数=2.故氦原子的结构示意图不应为  ,核内只有2个质子,核外只有2个电子,故C错误; D、氦原子结构示意图为
,核内只有2个质子,核外只有2个电子,故C错误; D、氦原子结构示意图为 ,氦原子核内两个质子,核外两个电子,故D正确。
,氦原子核内两个质子,核外两个电子,故D正确。
点睛∶原子结构示意图的含义∶原子结构示意图是表示原子核电荷数和电子层排布的图示形式。小圈和圈内的数字表示原子核和核内质子数,弧线表示电子层,弧线上的数字表示该层的电子数。


科目:初中化学 来源: 题型:
【题目】水与人类的生活和生产密切相关,请回答下列问题:

(1)图1是水的电解实验,试管a中产生的气体为_______,该反应的化学方程式为_______。
(2)将浑浊的河水用图2所示的简易净水器进行净化,其中活性炭的主要作用是_______,生活中降低水的硬度的方法是_______。
(3)图3实验中,水的作用为_______,若用pH试纸检测实验结束后集气瓶中液体的pH,则液体的pH_______7(填“<”或“=”或“>”)。
(4)图4为甲、乙、丙三种不含结晶水的固体物质的溶解度曲线.
①t1℃时,丙物质的溶解度为_______;
②t2°C 时将30g甲物质加入到50g水中,充分溶解,所得溶液的质量为_______g;
③将t2°C时乙的不饱和溶液逐渐冷却至t1℃,下图中有关量随时间变化的趋势一定错误的是_______。

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学与生活息息相关.
(1)如图1物品所使用的主要材料属于合成材料的是________(填字母序号,下同),属于无机材料的是__________。

(2)用过的铁锅保护不当很容易生锈,铁生锈的实质是铁与_______和_____发生复杂的化学变化。写出一种防止铁锅生锈的方法____________。
(3)“豌豆黄”如图2是一道传统小吃,根据表格中的信息回答下列问题.
品名 | 豌豆黄 |
主要原料 | 豌豆 |
主要营养成分 | 蛋白质、糖类、钠、钙、钾、镁等元素 |
①“豌豆黄”中主要含有蛋白质、糖类和_________三类营养素。
②豌豆黄”中含有钙元素,人体缺钙常会引起_________(填字母序号)。
A.贫血症B.侏儒症C、甲状腺肿大D、佝偻病
(4)下列做法会造成水体污染的有_________(填字母序号,下同)。
A.工业废水直接排放 B.生活污水集中处理后排放
C.不使用含磷洗衣粉 D.大量使用化肥农药
(5)“低碳”是一种生活理念,也是一种生活态度.下列做法中不符合“低碳”要求的是_____
A.节约纸张B.大量使用化石燃料
C.提倡使用节约技术和节能产品D.尽量乘坐公交车
(6)二甲醚(CH3OCH3)是一种可作为柴油替代资源的清洁燃料,二甲醚完全燃烧的化学方程式为______。
(7) 医院输液常用到的生理盐水是0.9%的氯化钠溶液。实验室配制溶质质量分数为5%的氯化钠溶液,有以下操作:①溶解②称量 ③计算④装瓶存放,贴上标签,正确的顺序是________(填序号)。量取蒸馏水时,若仰视读数,则导致溶质质量分数_________(填“大于”或“小于”)0.9%。若用该氯化钠溶液加水稀释配制500毫升(密度约为1g/ml)生理盐水,需要5%的氯化钠溶液________克。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】X、Y两种固体物质的溶解度曲线如图所示。下列说法正确的是( )
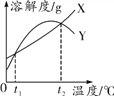
A. 溶剂不变时,t1℃ X的饱和溶液升温至t2℃仍是饱和溶液
B. 溶剂不变时,分别将t1℃ X、Y的饱和溶液升温至t2℃,所得溶液中溶质的质量分数相等
C. 相同温度时,X的溶解度一定大于Y的溶解度
D. Y的溶解度随温度的升高而增大
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】过氧化镁(MgO2)是一种镁精细化工产品。在医疗上可用来治疗消化不良、胃酸过多等疾病。在环境保护方面,过氧化镁可用来处理地下水污染的土壤。某化学兴趣小组对过氧化镁的性质和制备等进行了以下研究。
一.过氧化镁的性质
(1)过氧化镁是一种白色的粉末,其外观、物理性质与氧化镁相似。过氧化镁在常温下比较稳定,但是加热时会分解生成氧气和氧化镁。写出该反应的化学方程式____________。
(2)过氧化镁易溶于稀盐酸,发生反应:MgO2+2HCl=MgCl2+H2O2 。同时温度升高,说明该反应_____热量(填“放出”或“吸收”)。
二.过氧化镁的制备
下图是利用碱式碳酸镁【Mg2( OH)2CO3】和30%的过氧化氢溶液来制取过氧化镁。
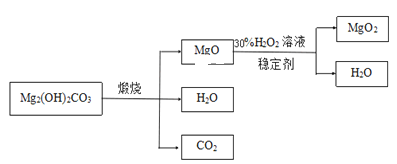
【资料】①碱式碳酸镁与碳酸镁有相似的化学性质,能与稀盐酸反应产生二氧化碳;
②氧化镁与过氧化氢反应放出大量的热。
(3)检测煅烧过程碱式碳酸镁已完全分解的方法是_________________(写出具体的操作和现象);上述生产过程加入稳定剂的作用是__________________。
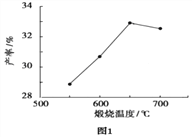
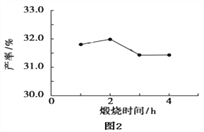
(4)用上述碱式碳酸镁在 550、600、650 及 700 ℃ 下煅烧一定的时间生成氧化镁,再用上述条件制备的氧化镁分别与 30% 双氧水反应生成过氧化镁的产率如下面的图1和图2。碱式碳酸镁煅烧的温度适宜控制在_______℃,煅烧的时间适宜控制在______h。
三.过氧化镁的纯度检测
在生产过程中,过氧化镁中常常含有少量的氧化镁杂质(其他杂质不考虑),以下是该小组进行纯度检测的实验装置和实验步骤。
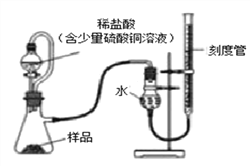
①装入药品(样品质量为0.7g),调节刻度管使左右两边液面相平,刻度管读数为10.0mL。
②打开分液漏斗开关,待瓶中无气泡产生时,关闭开关。
③再次调节刻度管使左右两边液面相平,刻度管读数为122mL。
(5)实验步骤中,装入药品前应先(_________)。
(6)稀盐酸中放入少量硫酸铜溶液的目的是______________。
(7)根据上面实验数据计算样品中过氧化镁的质量分数(写出具体的计算过程,该实验条件下O2密度为1.429g/L)。 ____________
(8)该小组同学所测得质量分数比实际结果偏大,你觉得可能的原因是(_______)
A.生成的氧气有少量溶于水 B.未等装置冷却到室温就开始读数
C.杂质与盐酸反应能产生少量的气体 D.滴入的稀盐酸占了一部分气体的体积
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下表回答问题:
温度(℃) | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 100℃ | |
溶解度 (g/100g 水) | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 246 |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 39.8 | |
① 20℃时,50 克水中最多能溶解 NaCl______ g。
② 将硝酸钾的不饱和溶液转化为饱和溶液的方法________。(任写一种方法)若硝酸钾溶液中混有少量氯化钠,可通过______的方法提纯。
③ 硝酸钾和氯化钠溶解度相同的温度范围为______。(填编号)
I. 0℃-10℃ II. 10℃-20℃ III. 20℃-30℃ IV. 30℃-40℃
④ 30℃时,在两个各盛有 100 克水的烧杯中,分别加入相同质量的硝酸钾和氯化钠,充分溶解后,其结果如图所示。
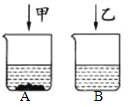
I. 两烧杯中的溶质质量分数大小关系为 A________ B。(填“>”“<”或“=”)
II. 加入的甲物质是________。
III. 对 B 中乙溶液的分析,正确的是______。
a. 加水,溶质质量分数一定变小
b. 一定是该温度下的不饱和溶液
c. 溶解的固体质量一定大于 36.3g,小于 45.8g d. 降温至 10℃,一定有晶体析出
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有一包白色固体,可能是碳酸钠、氯化钠、氢氧化钠、硝酸钡中的一种或几种,为确定 成分,进行如下实验(硝酸钠溶液和硝酸钡溶液均呈中性):
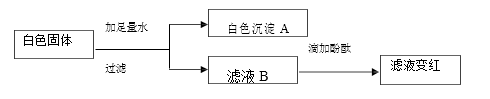
① 白色沉淀 A 是______,化学方程式是______。
② 滤液 B 中溶质一定有______,可能有______(任写一种情况); 为确定白色固体中可能存在的物质,进一步对滤液 B 进行实验,步骤如下:
Ⅰ. 重新取滤液 B,滴加过量的试剂 X; Ⅱ. 向Ⅰ中的溶液滴加过量的稀硝酸; Ⅲ. 向Ⅱ中的溶液滴加试剂 Y。完成填空:试剂 X 是__溶液(填“氯化钡”或“硝酸钡”);试剂 Y 是_________溶液。 若_______ (写现象及对应的步骤编号),能确定白色固体中含有氢氧化钠。 若_______(写现象及对应的步骤编号),能确定白色固体中含有氯化钠。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】结合图示回答问题
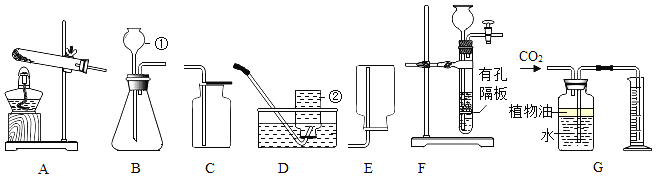
(1)写出图中标有序号的仪器名称:①_____,②_____。
(2)实验室用KMnO4制取O2,应选用的发生装置为_____(填字母,下同),收集装置可选一种是_____,写出该反应的化学方程式_____。
(3)注射器与装置B相连可用于检查装置B的气密性,步骤如下:
①向锥形瓶中加入少量水至_____。
②将注射器连接到装置B的导管口处。
③缓慢拉动注射器的活塞,观察到_____,说明装置B的气密性良好。
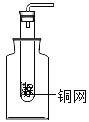
(4)学生甲选装置F制取CO2,F装置相对于B装置具有的优点是_____。甲在把石灰石装入试管时,不慎打破管底,其原因可能是:_____。后来学生乙用这支底部有破洞的试管和一个广口瓶组装成另外一套制取二氧化碳的发生装置(如图所示).在铜网上应盛放_____,广口瓶中应盛入_____。两种药品发生反应的化学方程式为_____。图G所示装置可用来测量生成CO2的体积,其中在水面上放一层植物油的目的是:_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业炼制是把铁矿石和焦炭等原料一起加入高炉,在高温下通入空气进行一系列反应把铁还原出来。
(1)通入空气使固态的焦炭转化为具有还原性的气态物质,转化过程中涉及的反应的化学方程式是①______________________________;②______________________________。
(2)赤铁矿(主要成分为Fe2O3)在高炉里反应生成单质铁的化学方程式是______________。
(3)某钢铁厂每天需消耗5000t含Fe2O3 80%的赤铁矿,该厂理论上可日产含铁98%的生铁的质量是__________t。(结果保留整数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com