
【题目】氧化镁在医药等行业应用广泛。实验室以菱镁矿(主要成分为MgCO3,含少量FeCO3,其他杂质不溶于水和酸)为原料制备高纯氧化镁的实验流程如下:
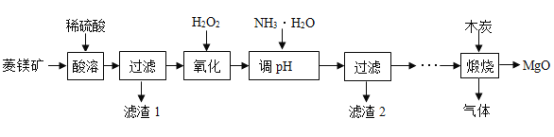
(1)为了提高“酸浸”的效果,可采取的措施有:适当升高温度、____________。MgCO3与稀硫酸反应的化学方程式为_________________。
(2)“氧化”过程中,将FeSO4全部转化为Fe2(SO4) 3,然后加氨水,调节溶液的PH范围为______________。(已知部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表)
对应离子 | Fe3+ | Fe2+ | Mg2+ |
开始沉淀时的pH | 2.7 | 7.9 | 9.4 |
完全沉淀时的pH | 3.7 | 9.6 | 11.4 |
(3)过滤后得到滤渣2和滤液,滤渣2是______(填化学式),此时滤液中的阳离子一定含有____________(填离子符号)。
(4)煅烧过程存在以下反应:![]() ;
;![]() ;
;![]()
已知:①硫在常温下是一种淡黄色固体,硫的熔点约为115.2°C,沸点约为444.7°C;②高锰酸钾溶液与SO2反应会褪色,且只吸收SO2,不吸收CO2;③碱溶液既吸收SO2,又吸收CO2。利用下图装置对煅烧产生的气体进行检验并收集。
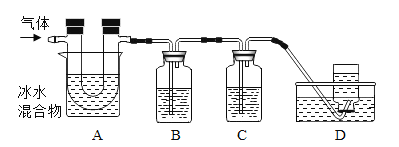
①集气瓶B中盛放的溶液是_______________(填字母),C中盛放的溶液是_____________(填字母)。
a Ca(OH)2溶液
b KMnO4溶液
c NaOH溶液
d BaCl2溶液
②装置D的作用是__________________________。
【答案】将矿石粉粹等 MgCO3+H2SO4=MgSO4+H2O+CO2↑ 3.7—9.4 Fe(OH)3 Mg2+、NH4+ b c 收集一氧化碳,防止污染空气
【解析】
(1)为了提高“酸浸”的效果,可采取的措施有:适当升高温度、将矿石粉粹等。MgCO3与稀硫酸反应生成了硫酸镁、二氧化碳和水,化学方程式为:MgCO3+H2SO4=MgSO4+H2O+CO2↑。
(2)“氧化”过程中,将FeSO4全部转化为Fe2(SO4)3,然后加氨水,为了将铁离子沉淀镁离子不沉淀,调节溶液的pH范围为:3.7—9.4。
(3)由题意可知,碳酸镁和硫酸反应生成硫酸镁、水和二氧化碳,过氧化氢在酸性条件下氧化硫酸亚铁为硫酸铁,硫酸铁与氨水反应生成了氢氧化铁沉淀和硫酸铵,所以滤渣2是Fe(OH)3,此时滤液中的阳离子一定含有:Mg2+、NH4+。
(4)①由题意可知,高锰酸钾溶液与SO2反应会褪色,且只吸收SO2,不吸收CO2; 碱溶液既吸收SO2,又吸收CO2,应先用高锰酸钾溶液检验并除去二氧化硫,再用石灰水检验二氧化碳、用氢氧化钠除去二氧化碳(或者足量石灰水检验并除去二氧化碳,题干中没有说明足量,不能选用),最后收集一氧化碳,所以集气瓶B中盛放的溶液是KMnO4溶液,C中盛放的溶液是NaOH溶液。
②混合气体通过A除去了硫,通过B检验并除去了二氧化硫,经过C中的碱溶液除去了二氧化碳,最后收集到的气体是一氧化碳,所以装置D的作用是:收集一氧化碳,防止污染空气。
故答案为:(1)将矿石粉粹等;MgCO3+H2SO4=MgSO4+H2O+CO2↑。
(2)3.7—9.4。
(3)Fe(OH)3;Mg2+、NH4+。
(4)①b;c;②收集一氧化碳,防止污染空气。


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
【题目】盛有等质量、等质量分数稀盐酸的两只烧杯,放在托盘天平的左右两盘,天平平衡,在左盘烧杯中加入 10gCaCO3,恰好完全反应,若要使天平重新平衡,则右盘烧杯中应加入的下列物质是( )
A.5.6g 铁和锌
B.10g 镁和氧化镁
C.10g 碳酸镁
D.10g 碳酸镁和碳酸锌
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是某同学所在化学活动实验小组同学的实验,他们在探究稀硫酸的某些化学性质,请回答下列问题:(如图)
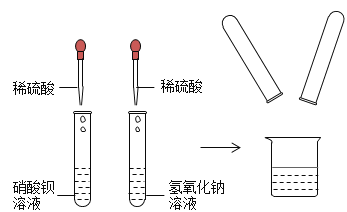
请写出右边试管中发生的反应方程式:_____。左边试管中的实验现象为_____。甲乙同学实验后,将左边试管过滤后的滤液和右边试管实验后的溶液倒入同一只烧杯中,观察到有白色沉淀生成,由此可知左边试管中溶质为_____,将烧杯中的沉淀滤去,得到滤液。
(提出问题)烧杯中滤液的溶质中离子除了Na和NO3-外,甲同学的猜想:OH-、SO42-
乙同学的猜想:OH-、Ba2
丙同学的猜想:H+、Ba2
还含有哪些离子?_________
(实验验证)丙同学为了验证自己的猜想,取烧杯中的溶液少许于试管中,向其中加入少量的硫酸钠溶液,观察到产生白色沉淀的现象,于是得出结论:自己的猜想正确,甲的猜想不正确。乙同学认为丙得出的结论不正确。请对丙同学的实验及现象做出评价_____。
乙同学进行了自己的验证实验,取少量烧杯中的溶液于试管中,向其中滴加硫酸铜溶液,观察到有白色和蓝色沉淀的现象,于是得出结论:其溶质中的离子成分是_____。
(反思与总结)乙、丙两位同学的实验所选用的试剂不同,得出结论也不相同,由两位同学的验证实验总结得出:在验证猜想的溶液中溶质离子成分时,所选试剂要求是_____就能一次性验证溶质离子成分。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室欲测定一瓶标签破损的稀硫酸中溶质的质量分数,现取10g稀硫酸样品,将5%的NaOH溶液逐滴加入到样品中,边加边搅拌,随着NaOH溶液的加入,溶液pH的变化情况如图所示。分析并计算:
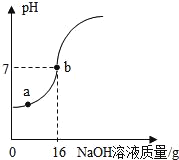
(1)a点溶液中含有的离子是_____。
(2)当pH=7时,消耗氢氧化钠溶液中NaOH质量为_____g。
(3)计算稀H2SO4中溶质的质量分数。_____
(4)计算恰好完全反应时所得溶液的溶质质量分数。_____
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列图像能正确反应其对应关系的是()
A.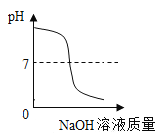 向一定体积的稀硫酸中逐滴加入足量的氢氧化钠溶液
向一定体积的稀硫酸中逐滴加入足量的氢氧化钠溶液
B.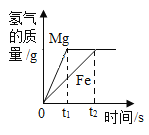 向足量的镁和铁中加入等质量、等质量分数的稀硫酸
向足量的镁和铁中加入等质量、等质量分数的稀硫酸
C.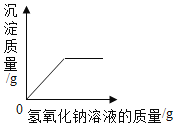 向硫酸镁和硫酸的混合溶液中逐渐加入氢氧化钠溶液
向硫酸镁和硫酸的混合溶液中逐渐加入氢氧化钠溶液
D.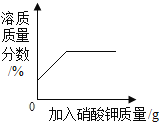 某温度下,向一定量饱和硝酸钾溶液中加入硝酸钾晶体
某温度下,向一定量饱和硝酸钾溶液中加入硝酸钾晶体
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列实验设计不能达到实验目的是( )
选项 | A | B | C | D |
实验目的 | 干燥二氧化碳 | 证明CO2密度比空气的大 | 测定空气中氧气含量 | 证明分子不断运动 |
实验方案 |
|
|
|
|
A.AB.BC.CD.D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小明同学已经知道镁能与氧气反应,还想用金属镁设计实验验证金属的其它化学性质。
预测 | 预测的依据 | 验证预测的实验操作与预期现象 |
①能够与酸反应 | 锌能与稀硫酸反应产生氢气,镁比锌活泼。 | _____,则预测成立 |
②能够与盐反应 | _____ | 往装有2mLCuSO4溶液的试管中放入一根用砂纸打磨干净的镁条,观察到镁条表面有气泡,一段时间后,蓝色溶液变淡,试管底部有红色固体。 |
小明发现,镁条放入CuSO4溶液中,镁条表面有气泡产生,为什么呢?小明想,镁是不是能跟水发生反应呢?
于是,他将镁条放到盛有冷水(蒸馏水)的试管中,没有明显的现象,然后将试管放在酒精灯上加热,发现试管中有气泡产生。
(提出问题)加热时镁条与水发生反应吗?生成的物质是什么呢?
(猜想与假设)
(1)甲同学认为,加热时应该先将蒸馏水煮沸并迅速冷却,理由是_____。
(2)甲同学认为,加热时镁和水反应生成的气体是_____(选填a、H2或b、N2),不选择另一项的理由是_____。
(实验验证)乙同学向加热的试管中滴入酚酞溶液,溶液显红色。
(实验结论)
(3)镁在加热时与水发生反应,因为加热后溶液中生成了_____性物质。请根据分析写出二者反应的化学方程式_____,看来,关于镁与硫酸铜溶液的反应还是比较复杂的,小明决定接下来跟老师一起继续探究。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是甲、乙两物质的溶解度曲线图,下列说法不正确的是( )
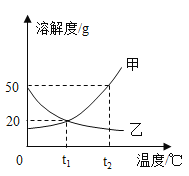
A.t2℃时,甲物质的溶解度大于乙物质的溶解度
B.将t2℃时甲物质的饱和溶液降温到t1℃,溶液仍然饱和
C.t1℃时,将l5g乙物质加入到50g水中,充分搅拌,能得到乙的饱和溶液
D.将t2℃时甲、乙两种物质的饱和溶液降温至t1℃,所得溶液中溶质质量分数大小为甲=乙
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下列实验装置图,按要求回答下列问题:

(1)写出仪器a的名称:_______________。
(2)实验室可用高锰酸钾制取氧气,其反应的化学方程式为①_______________,基本反应类型为②_______________; 选用的发生装置是③_______________,收集装置是④_______________。
(3)实验室制取并收集二氧化碳应选择的装置为①_______________。验满二氧化碳的方法是②_______________。
(4)小明同学用F装置验证二氧化碳的性质,当通入一段时间后,试管①中产生的现象是_______________,试管②中澄清石灰水变浑浊,反应的化学方程式为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com