
【题目】在“绿色化学工艺”中,理想状态是反应中的原子全部转化为欲制得的产物,即原子的利用率为100%。在用丙炔(![]() )合成甲基丙烯酸甲酯(
)合成甲基丙烯酸甲酯(![]() )的过程中,欲使原子的利用率达到最高,在催化剂作用下还需要的其他反应物是( )
)的过程中,欲使原子的利用率达到最高,在催化剂作用下还需要的其他反应物是( )
A.![]() 和
和![]() B.
B.![]() 和CO
和CO
C.![]() 和
和![]() D.
D.![]() 和
和![]()
【答案】AB
【解析】
由题意知,绿色化学即环境友好型化学,其理想状态是反应中原子全部转化为欲制得的产物,即原子的利用率为100%,根据这一观点,要把一个![]() 分子变成一个
分子变成一个![]() 分子,还必须增加2个C原子、4个H原子、2个O原子,即原料中C、H、O的原子个数比为1:2:1。
分子,还必须增加2个C原子、4个H原子、2个O原子,即原料中C、H、O的原子个数比为1:2:1。
A. ![]() 和
和![]() ,这两种物质如果按照分子个数比1:1组合,则可使C、H、O的原子个数比达到1:2:1,故A正确;
,这两种物质如果按照分子个数比1:1组合,则可使C、H、O的原子个数比达到1:2:1,故A正确;
B. ![]() 和
和![]() 按照分子个数比1:1组合,则可使C、H、O的原子个数比达到1:2:1,故B正确;
按照分子个数比1:1组合,则可使C、H、O的原子个数比达到1:2:1,故B正确;
C. ![]() 和
和![]() ,其中两种物质里三种原子不论怎样组合也都不能使C、H、O的原子个数比为1:2:1,故C错误;
,其中两种物质里三种原子不论怎样组合也都不能使C、H、O的原子个数比为1:2:1,故C错误;
D. ![]() 和
和![]() ,其中两种物质分子里三种原子不论怎样组合都不能使C、H、O的原子个数比为1:2:1,故D错误。
,其中两种物质分子里三种原子不论怎样组合都不能使C、H、O的原子个数比为1:2:1,故D错误。
故选AB.


科目:初中化学 来源: 题型:
【题目】阅读下面科普短文。 可燃冰,又称天然气水合物,一种外观似冰且遇火即燃的结晶化合物,其分子由甲烷分子和水分子构成,具有笼状结构(如图)。

可燃冰主要蕴藏在深海沉积物和陆地永久冻土中,由水和天然气在高压和低温条件下结晶而成,当温度升高或压强降低时,会立即分解释放出可燃性气体——甲烷。
可燃冰燃烧值高、污染小,且储量丰富,因而被各国视为未来化石燃料的替代能源。

图 1 当今世界能源储量对比图 图 2 能量密度对比图
可燃冰的开采方法主要有四种:①热激发法:对可燃冰加热,使温度超过可燃冰的平衡温度,从而分解为水 和天然气;②减压法:降低压力促使可燃冰分解;③化学试剂注入法:向矿层注入化学试剂,破坏其平衡条件促 使分解;④二氧化碳置换法:注入二氧化碳以置换可燃冰中的甲烷,触发甲烷扩散。
随着开采技术的不断进步,可燃冰势必会成为广泛使用的洁净能源。依据文章内容回答下列问题。
(1)写出可燃冰中含有的元素:___________。
(2)可燃冰的形成有三个基本条件:原材料(水和天然气)、__________和___________。
(3)甲烷燃烧的化学方程式为_________。
(4)可燃冰被视为“未来能源”的理由是_____________。
(5)下列说法正确的是________(填序号)。
A 可燃冰能燃烧,说明水具有可燃性
B 当今世界能源储量中,可燃冰居首
C 可燃冰的能量密度约为煤的十倍
D 我国研发冷冻取样、高温脉冲加热的“冷钻热采”可燃冰开采技术,属于热激发法
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是家庭中一些常见食品及生活用品的pH。下列说法正确的是( )

A.从以上物质的pH值看,肥皂水的碱性比玉米粥的碱性弱
B.在白醋中滴加几滴无色酌酞试液后,溶液变成红色
C.被蚊叮咬(分泌物中含蚁酸)可徐抹少量牙膏减轻疼痛
D.从食物本身的酸碱性来看,胃酸过多的人宜多吃葡萄来减缓不适
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】利用如图1仪器进行气体的制取实验,并分析回答问题。![]() 查阅信息:二氧化碳难溶于饱和的碳酸氢钠溶液且不与碳酸氢钠发生反应
查阅信息:二氧化碳难溶于饱和的碳酸氢钠溶液且不与碳酸氢钠发生反应![]()

(1)仪器B、G的名称分别是_____和_____。
(2)用一定质量的氯酸钾和二氧化锰的混合物制取并收集一瓶较纯净的O2,应选用图中的仪器有_____(填字母序号),此反应的化学方程式为_____,该反应过程固体混合物中二氧化锰的质量分数_____(填“增大”或“减小”或“不变”)。
(3)若用如图2装置制备二氧化碳或氢气,需改进之处为:_____,改进后该装置的优点是_____。

(4)收集二氧化碳可采用的方法有_____。
A向上排空气法
B向下排空气法
C排饱和碳酸氢钠溶液
(5)阅读“资料”卡片,分析下列说法正确的是_____![]() 填序号
填序号![]() 。
。
资料
1.氨气是有刺激性气味的无色气体,密度比空气小,极易溶于水,其水溶液呈碱性;
2.加热熟石灰和氯化铵的固体混合物生成氨气。
A制取氨气的发生装置与实验室用双氧水制氧气的发生装置相同
B若用如图3装置收集氨气,进气口应为n端
C检验氨气集满的方法是将干燥的红色石蕊试纸放在m管口,若变蓝则已满
D实验室可用浓硫酸干燥氨气
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为防止大气污染,工业上产生的硫化氢(H2S)要经过处理,使其变成硫单质。富玛克斯法治理硫化氢的方法和步骤如下:
①用 2%~3%的 Na2CO3溶液作吸收剂生成两种酸式盐,其中一种为 NaHS;
②再加入一种 RNO(液)(R 表示一种有机基团)与生成的这种酸式盐(NaHS)的水溶液反应生成硫、碱和 RNHOH;
③第二步生成的碱在溶液中与另一种酸式盐反应生成正盐;
④RNHOH 与空气中的氧发生反应又得到 RNO。
(1)写出上述有关反应的化学方程式。
① _________;
③______________;
(2)富玛克斯法的总反应的化学方程式为:__________ ,RNO 在整个过程中起到_________的作用。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知 Na2CO3与 HCl 反应分两步进行:
第一步 Na2CO3与 HCl 反应生成 NaHCO3:![]() ;
;
第二步 NaHCO3 与 HCl 反应生成 CO2:![]() 。
。
现有这样一个实验:在两支试管中分别加入 3mL 稀盐酸,将两个各装有 0.3g NaHCO3 或 Na2CO3 粉末的小气球分别套在两支试管口,将气球内的NaHCO3或 Na2CO3 同时倒入试管中(反应中盐酸足量)。观察到现象如下:
(1)盛________的试管中产生气体的速率要快得多。
(2)盛_________的试管中气球变得更大,大小气球中生成气体的质量之比为(填最简单整数比)_____。
(3)甲同学用手触摸试管,发现盛 NaHCO3 粉末的试管变冷,而盛 Na2CO3的试管温度有升高。为研究是吸热还是放热反应,继续进行了下列实验(每次实验各做 3 次平行实验,取平均值):
序号 | 试剂 1 | 试剂 2 | 混合前温度 | 混合后温度 |
① | 35mL 水 | 2.5g NaHCO3固体 | 20℃ | 18.5℃ |
② | 35mL 水 | 3.2 Na2CO3固体 | 20℃ | 24.3℃ |
③ | 35mL 稀盐酸 | 含2.5g NaHCO3的饱和溶液 32.5mL | 20℃ | 19℃ |
④ | 35mL 稀盐酸 | 含 3.2g Na2CO3的饱和溶液 23.1mL+10ml 水 | 20℃ | 24.2℃ |
⑤ | 35mL 稀盐酸 | 2.5gNaHCO3固体 | 20℃ | 16.2℃ |
⑥ | 35mL 稀盐酸 | 3.2g Na2CO3固体 | 20℃ | 25.1℃ |
通过上述实验可得出五条结论:
①NaHCO3 的溶解是__(吸热或放热)过程;
②Na2CO3 的溶解是____(吸热或放热)过程;
③NaHCO3 的饱和溶液和盐酸的反应是___(吸热或放热)反应;
④Na2CO3 的饱和溶液和盐酸的反应是____(吸热或放热)反应;
⑤NaHCO3 固体与稀盐酸反应的反应热是由_____(填①~⑤序号)的热效应之和。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某校课外活动小组的同学在老师的帮助下,探究用赤铁矿(主要成分是Fe2O3)炼铁的主要反应原理。他们设计的实验装置如下图所示。回答下列问题:
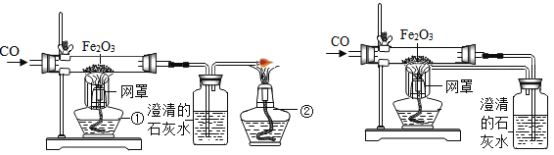
(1)写出用一氧化碳还原氧化铁的化学反应方程式:_____。
(2)实验中澄清石灰水作用是_____。
(3)图甲中第①个酒精灯上网罩的作用是_____。实验时应先点燃第_____个酒精灯。
(4)图乙与图甲相比,它的主要优点是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如下图所示,甲、乙、丙、丁、戊五种物质(或其溶液)俨然是滑冰赛道上参加接力比赛的“运动员”,相邻“运动员”之间能发生化学反应。已知:五种物质分别是Fe、HCl、KOH、CaCO3和CuCl2,中的一种,其中,甲是单质,丁与戊反应产生的气体可以熄灭终点的火炬。
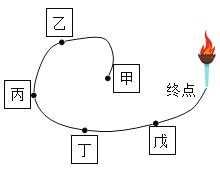
(1)甲能分别与另四种物质中的___________、____________反应(写化学式)。
(2)丁与戊反应的化学方程式为____________。
(3)丙与丁反应的化学方程式为_________。属于_________(填基本反应类型)。
(4)若把无机物按单质、氧化物、酸、碱和盐进行分类,无机物x的类别不同于上述五种物质,如果用X替换戊,它也能与丁反应生成一种生活中常用的液态灭火剂,X是__________(写一种),其发生反应的化学方程式为__________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用下图装置进行实验。
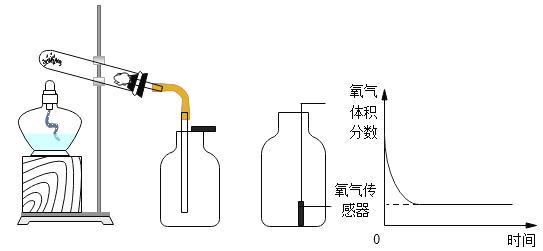
(1)用如图装置制取氧气的化学方程式为_______。
(2)待氧气收集满后,向集气瓶中放入氧气传感器(如图),测得数据如图。
①从微观角度解释氧气体积分数下降的原因_______。
②随着实验进行,测出氧气体积分数约为_______时数值几乎不再变化。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com