
【题目】已知 Na2CO3与 HCl 反应分两步进行:
第一步 Na2CO3与 HCl 反应生成 NaHCO3:![]() ;
;
第二步 NaHCO3 与 HCl 反应生成 CO2:![]() 。
。
现有这样一个实验:在两支试管中分别加入 3mL 稀盐酸,将两个各装有 0.3g NaHCO3 或 Na2CO3 粉末的小气球分别套在两支试管口,将气球内的NaHCO3或 Na2CO3 同时倒入试管中(反应中盐酸足量)。观察到现象如下:
(1)盛________的试管中产生气体的速率要快得多。
(2)盛_________的试管中气球变得更大,大小气球中生成气体的质量之比为(填最简单整数比)_____。
(3)甲同学用手触摸试管,发现盛 NaHCO3 粉末的试管变冷,而盛 Na2CO3的试管温度有升高。为研究是吸热还是放热反应,继续进行了下列实验(每次实验各做 3 次平行实验,取平均值):
序号 | 试剂 1 | 试剂 2 | 混合前温度 | 混合后温度 |
① | 35mL 水 | 2.5g NaHCO3固体 | 20℃ | 18.5℃ |
② | 35mL 水 | 3.2 Na2CO3固体 | 20℃ | 24.3℃ |
③ | 35mL 稀盐酸 | 含2.5g NaHCO3的饱和溶液 32.5mL | 20℃ | 19℃ |
④ | 35mL 稀盐酸 | 含 3.2g Na2CO3的饱和溶液 23.1mL+10ml 水 | 20℃ | 24.2℃ |
⑤ | 35mL 稀盐酸 | 2.5gNaHCO3固体 | 20℃ | 16.2℃ |
⑥ | 35mL 稀盐酸 | 3.2g Na2CO3固体 | 20℃ | 25.1℃ |
通过上述实验可得出五条结论:
①NaHCO3 的溶解是__(吸热或放热)过程;
②Na2CO3 的溶解是____(吸热或放热)过程;
③NaHCO3 的饱和溶液和盐酸的反应是___(吸热或放热)反应;
④Na2CO3 的饱和溶液和盐酸的反应是____(吸热或放热)反应;
⑤NaHCO3 固体与稀盐酸反应的反应热是由_____(填①~⑤序号)的热效应之和。
【答案】NaHCO3 NaHCO3 53:42 吸热 放热 吸热 放热 ①③
【解析】
首先读懂信息:碳酸钠与盐酸的反应分两步进行,所以可以判断碳酸氢钠反应更快;利用相同质量的物质,根据化学方程式的计算,可以得到产生二氧化碳的质量比;对表格的实验进行对比分析得出放热还是吸热。
(1)利用题中所给信息知碳酸钠与盐酸的反应是分两步进行,而碳酸氢钠与盐酸是一步进行,盛NaHCO3的试管中产生气体的速率要快得多。
(2)0.3g NaHCO3 或 Na2CO3分别与盐酸反应(反应中盐酸足量),分别计算生成二氧化碳的质量:
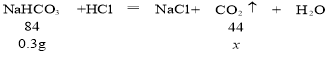
![]()
解得:![]() =
=![]() ≈ 0.16g,
≈ 0.16g,
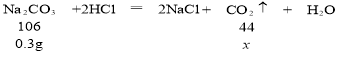
![]()
解得:![]() =
=![]() ≈ 0.12g
≈ 0.12g
所以NaHCO3产生的二氧化碳多,盛NaHCO3的试管中气球变得更大,大小气球中生成气体的质量之比为:![]() =53:42;
=53:42;
(3)①水的混合前温度20℃,加入NaHCO3混合后温度18.5℃,则NaHCO3的溶解是为吸热过程;
②水的混合前温度20℃,加入Na2CO3混合后温度24.3℃,则Na2CO3的溶解是为放热过程;
③稀盐酸、NaHCO3的饱和溶液的混合前温度20℃,混合后温度19℃,则NaHCO3的饱和溶液和盐酸的反应是吸热过程;
④稀盐酸、Na2CO3的饱和溶液的混合前温度20℃,混合后温度24.2℃,则Na2CO3的饱和溶液和盐酸的反应是放热过程;
⑤NaHCO3固体与稀盐酸反应的反应热是由碳酸氢钠固体溶于水的热效应与碳酸氢钠溶液与稀盐酸反应的热效应之和,即①③之和。


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:初中化学 来源: 题型:
【题目】(5分)实验室常用下图所示的装置制取气体和气体性质的验证,请回答:
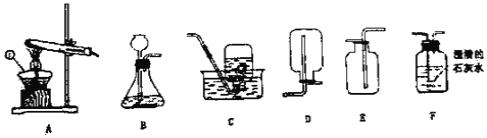
(1)仪器①的名称___________。
(2)图示装置中有明显错误的装置是______________(填序号)。
(3)实验室用高锰酸钾制取氧气,可选取的收集装置是_______(填序号),发生反应的化学方程式是__________________________________。
(4)某同学利用石灰石和盐酸通过装置B、F来验证二氧化碳的性质,实验过程中观察到F中有气泡冒出,澄清的石灰水未变浑浊,试分析其可能的原因______________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(1)金属铁及其化合物在生产生活中有极其广泛的应用。
①高铁酸钠(化学式Na2FeO4)是一种含铁元素的新型绿色消毒剂,主要用于饮用水处理。此化合物中铁元素的化合价为_____。
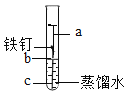
②小雪同学在探究铁生锈条件的实验时,按图装置进行实验,一周后发现铁钉锈蚀最严重的位置是_____处(从“a”“b”“c”中选择之一),取出铁钉后,她用盐酸除去表面的铁锈(主要成分为Fe2O3),发生反应的化学方程式为_____。
(2)我国海岸线长达3.2万千米。海洋专属经济区幅员辽阔,海洋资源丰富,开发的前景十分远大。海水中除了蕴含大量的钠元素和镁元素外,还含有大量的钾元素。KCl和KNO3的溶解度曲线如图所示,试回答下列问题:
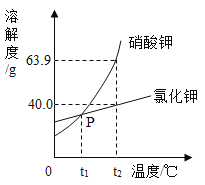
①t2℃时,硝酸钾的溶解度_____氯化钾的溶解度(填“大于”“等于”“小于”之一)。
②将t2℃时氯化钾的饱和溶液70g稀释成溶质质量分数为20%的氯化钾溶液。需加水_____g。
③将t1℃时硝酸钾饱和溶液和氯化钾饱和溶液分别升温至t2℃,此时硝酸钾溶液的溶质质量分数_____氯化钾溶液的溶质质量分数(选填"大于”“等于”“小于”“无法确定之一)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】科学家最近在-100℃的低温下合成一种化合物 X,此分子的模型如下图,其中每个![]() 代 表一个碳原子,每个
代 表一个碳原子,每个![]() 代表一个氢原子。下列说法中不正确的是
代表一个氢原子。下列说法中不正确的是

A.该分子的分子式为 C5H4
B.该分子中碳元素的质量分数是 93.75%
C.该物质中碳元素的化合价为+4 价
D.等质量的该物质与甲烷相比,燃烧时该物质消耗的氧气更多
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在“绿色化学工艺”中,理想状态是反应中的原子全部转化为欲制得的产物,即原子的利用率为100%。在用丙炔(![]() )合成甲基丙烯酸甲酯(
)合成甲基丙烯酸甲酯(![]() )的过程中,欲使原子的利用率达到最高,在催化剂作用下还需要的其他反应物是( )
)的过程中,欲使原子的利用率达到最高,在催化剂作用下还需要的其他反应物是( )
A.![]() 和
和![]() B.
B.![]() 和CO
和CO
C.![]() 和
和![]() D.
D.![]() 和
和![]()
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下表是元素周期表的部分内容,回答下列问题。
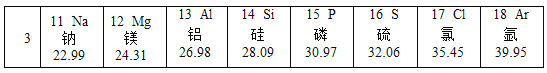
(1)1869年俄国化学家______________(填“道尔顿”“门捷列夫”“阿伏加德罗”或“居里”)列出了第一张有代表性的元素周期表;
(2)请从上表中查出硅元素的一条信息____________________。
(3)已知某微粒的结构示意图为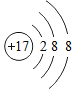 ,该微粒的符号为
,该微粒的符号为
(4)根据表中内容,可总结出的一条规律是____________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】洋葱中含有一种具有强烈刺激性气味的物质——正丙硫醇(CH3CH2CH2SH)。切洋葱时,正丙硫醇会挥发出来,刺激人流泪。下列说法不正确的是( )
A.正丙硫醇由三种元素组成
B.正丙硫醇中碳原子、氢原子和硫原子的个数比为3∶8∶1
C.正丙硫醇中碳的质量分数为37.4%
D.一个正丙硫醇分子的相对分子质量为76
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小明将未打磨的铝片和稀盐酸放入密闭容器中,用传感器探究反应过程中温度和压强的变化,如右图所示。从图中所获信息不正确的是


A. 反应过程中有热量放出B. 50s时,溶液中溶质为AlCl3
C. 0~50s,发生Al2O3+6HCl===2AlCl3+3H2O反应D. 100—140s,压强减小是因为温度降低
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】阅读下面科普短文。
炭烧酸奶近年来发展迅速,其焦香浓郁的风味深受消费者喜爱。炭烧酸奶在制作过程中通过牛奶的长时间褐变,获得浓郁的焦香风味。牛奶褐变,是一系列化合物受热发生反应的过程。褐变生产工艺中需对葡萄糖用量、褐变温度和褐变时间三个重要条件进行严格控制。葡萄糖用量与产品颜色、风味密切相关,具体影响如图 2 所示,其中评分越高,产品的颜色、风味越好。褐变温度和时间的组合是调节蛋白稳定、避免沉淀分层的重要因素,具体影响如表所示,其中沉淀率越低产品越稳定。

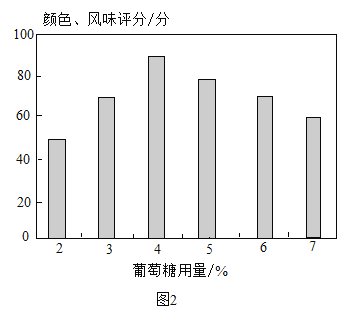
表:褐变温度和时间对牛奶褐变沉淀率的影响
褐变温度/℃ | 86 | 88 | 90 | 92 | 94 | 96 |
褐变时间/h | 6 | 4 | 3.5 | 3 | 2.5 | 2 |
沉淀率/% | 0.35 | 0.31 | 0.27 | 0.22 | 0.14 | 0.44 |
优质的制作工艺可使炭烧酸奶口感爽滑,在保质期内状态稳定。依据文章内容回答下列问题。
(1)葡萄糖(C6H12O6)的相对分子质量是180,计算式为______。
(2)制作炭烧酸奶的原料有___________。
(3)牛奶褐变过程中,影响蛋白稳定的因素有_____________。
(4)由图表可知,牛奶褐变过程的最佳条件为_________。
(5)下列说法正确的是______(填序号)。
A 炭烧酸奶的特色是其浓郁的焦香风味
B 葡萄糖用量影响产品的颜色和风味
C 褐变温度越高,炭烧酸奶产品越稳定
D 炭烧酸奶制作过程中需将各种原料一次性混合均匀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com