
【题目】氯化钠和硫酸镁的溶解度曲线与若干温度下的溶解度表如下:
温度/℃ | 20 | 30 | 40 | 60 | 80 | 90 | 100 | |
溶解度 (g/100GH20) | NaCl | 36.0 | 36.3 | 36.6 | 37.3 | 38.4 | 39.0 | 39.8 |
MgSO4 | 33.7 | 38.9 | 44.5 | 54.6 | 55.8 | 52.9 | 50.4 | |
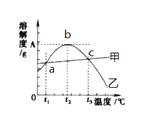
请回答下列问题:
(1)80℃时,硫酸镁的溶解度为__________,溶解度曲线甲所代表的物质是__________。a点对应的温度t1范围是____________________。
(2)t2℃时有含有较多NaCl 的MgSO4溶液,为了得到纯净的MgSO4,可采用的方法__________
(3)40℃时把20g NaCl放入50g水中,形成的溶液中溶质质量分数为__________(精确到0.1%),要使t3℃饱和的MgSO4溶液中溶质质量分数增大,可采用的措施是__________。
【答案】 55.8g 氯化钠 20°C<t1<30°C 降温结晶 过滤析出的晶体 洗涤、烘干 26.8% 适当降温并加入MgSO4固体
【解析】(1)由溶解度表可知,80℃时,硫酸镁的溶解度为55.8g,从溶解度曲线可知,甲所代表的物质溶解度随温度的升高而增大,故甲是氯化钠。a点表示在某一温度时,氯化钠与硫酸镁的溶解度相等,根据溶解度表可知,两种物质溶解度相等对应的温度范围是20°C<t1<30°C。(2)由溶解度曲线看出,在0°C~t2℃范围内,硫酸镁的溶解度随温度的升高而增大,且受温度影响较大,而氯化钠的溶解度受温度影响不大,所以为了得到纯净的MgSO4,可用降温结晶法,然后将过滤析出的晶体洗涤、烘干。(3)40℃时,氯化钠的溶解度是36.6g,50g水中最多能溶解 18.3g氯化钠,所以把20g NaCl放入50g水中,形成的溶液中溶质质量分数为:![]() ×100%=26.8%。由t3℃时降温,硫酸镁的溶解度增大,所以要使t3℃饱和的MgSO4溶液中溶质质量分数增大,可采用的措施是适当降温并加入MgSO4固体。
×100%=26.8%。由t3℃时降温,硫酸镁的溶解度增大,所以要使t3℃饱和的MgSO4溶液中溶质质量分数增大,可采用的措施是适当降温并加入MgSO4固体。


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:初中化学 来源: 题型:
【题目】为了验证一氧化碳的性质,某实验探究小组通过查阅资料得知:固体草酸(H2C2O42H2O)受热可分解,其化学方程式是:H2C2O42H2O=3H2O↑+CO2↑+CO↑,可制得一氧化碳气体。根据下图进行实验:
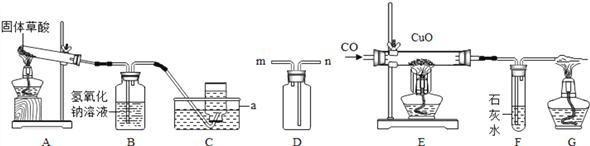
(1)写出仪器a的名称 _________。
(2)若在装置A的试管口添加一团棉花用来制取氧气,写出反应的化学方程式___________,若用D装置收集氧气,氧气应从______(填m或n)端进入,检验氧气已经收集满的方法:_________。
(3)若要验证草酸分解产物中有二氧化碳和水蒸气生成,将生成的混合气体依次通过 ______和__________(填试剂名称),即可验证。
(4)在上述验证CO性质的实验中,应先点燃 _______处酒精灯(选填“E”或“G”),实验中观察到装置E中的现象: _____________。
(5)上述CO的制备与性质实验中,说明CO具有的性质有: ________ 。
A.还原性 B.可燃性 C.毒性 D.难溶于水
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图为氢氧化钠固体在水中和酒精中的溶解度曲线,下列有关说法不正确的是( )
A. 氢氧化钠易溶于酒精
B. 氢氧化钠在水和酒精中的溶解度都随温度的升高而增大
C. 20℃时,氢氧化钠水溶液比酒精溶液的溶质质量分数大
D. 40℃时,饱和氢氧化钠水溶液降温到20℃会有固体析出
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学兴趣小组用以下装置探究炼铁的原理(根据需要酒精灯可加网罩)。
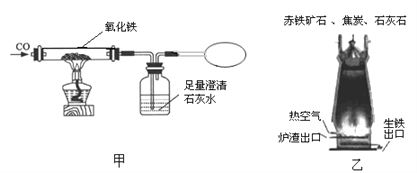
(1)乙图中高炉炼铁时焦炭的作用是_________。
(2)装置甲“炼”得的铁与装置乙炼出的生铁在组成上的最大区别是______。
(3)甲、乙两装置中共同发生的化学反应是__________(用化学方程式表示)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国著名化学家侯德榜先生发明了“侯氏制碱法”,其原理中重要的一步是向饱和食盐水中先后通入足量NH3和CO2制备NaHCO3,化学方程式:NaCl+ NH3+CO2+H2O= NaHCO3↓+NH4Cl
某兴趣小组在实验室模拟该过程,请结合具体的步骤回答下列问题:
I.气体制备
(1)二氧化碳气体制备
实验室常采用石灰石与稀盐酸反应制备CO2,其化学方程式为_____________。应选择的气体收集装置为______(选填装置对应的字母)。
(2)氨气制备
实验室常用硫酸吸收氨气,防止污染空气,实验室制备NH3的反应原理为:Ca(OH)2(固)+2NH4Cl(固) ![]() CaCl2+2H2O+2NH3↑。现要制备并干燥NH3,所选装置的正确连接顺序为_____→______(选择装置对应的字母)。实验室制备O2也可用上述制备NH3的发生装置,写出用该发生装置制备O2的化学方程式__________。
CaCl2+2H2O+2NH3↑。现要制备并干燥NH3,所选装置的正确连接顺序为_____→______(选择装置对应的字母)。实验室制备O2也可用上述制备NH3的发生装置,写出用该发生装置制备O2的化学方程式__________。
II.NaHCO3制备
物质 | NaHCO3 | NH4Cl |
溶解度/g(20℃) | 9.6 | 37.2 |
(3)根据表格中的溶解度数据,解释20℃产物中NaHCO3能够先从溶液中结晶析出的原因________。
(4)该过程中另一产物NH4Cl在农业生产中常被用作______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
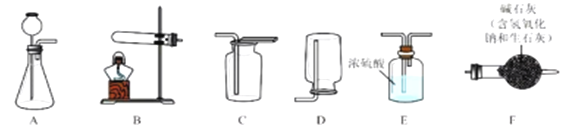
【题目】实验室利用不同的装置制取得到不同的气体。下图是实验室制取气体的各种装置。
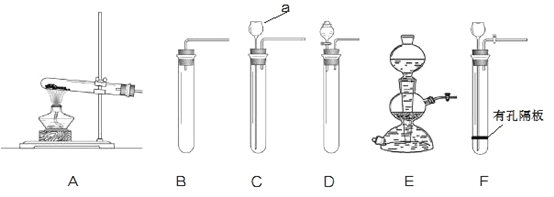
①图中仪器“a”的名称是______。制取气体的装置,放入药品前,均需对装置进 行______检查。
②上述装置按照不同角度可以分为两类,完成表格空白处:
分类依据 | 装置编号 | |
反应条件 | 加热 | A |
不加热 | BCDEF | |
(3) | 固体与固体 | A |
固体与液体 | BCDEF | |
若将“BCDEF”继续分为两类:“BCD”和“EF”两类,“EF”放在一起的理由是:________。
③如果实验室利用氯化铵固体与氢氧化钙固体在加热条件下得到氨气,选用的装置可以是______(选填图中装置编号);实验室利用大理石与稀盐酸反应制取 CO2,若要得到较 多的气体,装置宜选用_______(选填图中装置编号)。
④实验室利用大理石与稀盐酸反应制取 CO2,反应中共消耗了 3.65%的稀盐酸 100g,计算该 盐酸溶液中含 HCl 的物质的量是多少?可以得到 CO2 气体的质量是多少________?(请列式计算)
(7)计算 HCl 的物质的量:_______
(8)计算 CO2 气体的质量:________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】烧杯中有一些久置的氢氧化钠溶液 A,为确定其变质情况,进行如下实验。
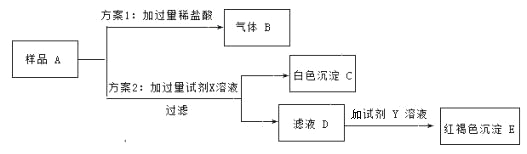
(1)生成气体 B 的化学方程式______________。
(2)试剂 X 是______________(选填“硝酸钡”或“氢氧化钡”)溶液。
(3)若所加试剂 Y 是氯化铁溶液,则生成红褐色沉淀 E 的化学方程式______________ 。
(4)滤液 D 中溶质的成分有______________。
(5)结论:由方案 2 可知,烧杯中氢氧化钠溶液是______________(填“部分变质”或“完全变质”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示,在6支试管中分别低价2滴紫色石蕊溶液。(资料:KCl溶液、CaCl2溶液均显中性)
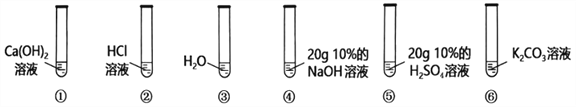
(1)作为对照试验的是试管__________(选填①~⑥编号)。
(2)试管②、⑤溶液变为红色,其原因是溶液中溶质都含有________元素。
(3)试管⑥中溶液变为蓝色,说明碳酸钾溶液显________(选填“酸性”、“中性”或“碱性”)。碳酸钾属于________(填物质类别),可做________肥使用,取该溶液灼烧,透过蓝色钴玻璃火焰呈________色。
(4)将试管⑤倒入试管④中,写出该反应的化学方程式________________________________。
充分反应后溶液呈现________________。
A.红色 B.紫色 C.蓝色
(5)实验后将试管①②⑥中的废液倒入大烧杯中,最终得到红色溶液,则大烧杯的废液中除了石蕊外,一定还含有________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有如下四种粒子的结构示意图:
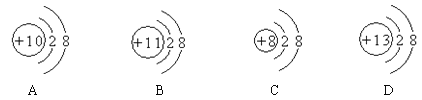
(1)其中属于阴离子的是_________;在化学反应中能够得到电子变成原子的是_________。
(2)下列关于四种粒子的叙述错误的是__________。
A.它们的原子序数不相同
B.它们的核外电子数相同
C.它们都属于金属元素
D.它们都是稳定结构
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com