
【题目】钴(Co)常见化合价为+2、+3。资料:氢氧化钴 Co(OH)2粉红色固体,难溶于水;氢氧化高钴Co(OH)
(1)写出硫酸高钴的化学式_________________;CoCO读作_________________。
(2)写出氯化钴溶液和氢氧化钠溶液反应的化学方程式_________________________________。
(3)2Co(OH)+6_________________=2CoCl+Cl↑+6HO
(4)177g钴在空气中加热至白热时完全燃烧生成________g Co3O4
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组的同学利用下图装置制取并收集一瓶二氧化碳气体,请和他们一起完成以下实验探究。

(1)写出标号①的仪器名称__________。
(2)实验室制取一瓶二氧化碳气体,应选用的收集装置为__________(填序号),反应的化学方程式为__________。
(3)化学兴趣小组的同学对反应后废液中溶质的成分进行进一步探究。
【提出问题】 废液中的溶质含有哪些物质?
【查阅资料】 氯化钙溶液呈中性。
【猜想与假设】 猜想①:废液中的溶质只有氯化钙;
猜想②:废液中的溶质是氯化钙和__________(填化学式)。
【设计并进行实验】 I.为验证上面两种猜想哪种正确,甲小组的同学从下面A~E五种药品中选择合适的一种进行实验,证明了猜想②是正确的。他们选择的药品不可能是__________。
A.紫色石蕊试液 B.无色酚酞试液 C.锌粒 D.氧化铁粉末 E.氢氧化钠溶液
Ⅱ.乙小组用一种钠盐溶液进行实验,也证明了猜想②是正确的,请完成下面的实验报告。
实验操作 | 实验现象 | 实验结论 |
取少量反应后的废液于试管中,加入足量_______(填化学式)溶液,振荡。 | ____________ | 猜想②正确 |
【探究反思】:实验产生的污染深受人们重视,我们要利用恰当的方法对废液进行处理,实行无害化排放,从源头上消除对环境的污染。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请结合下列实验常用装置,回答有关问题。
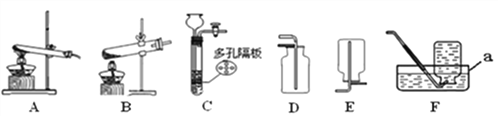
(1)写出仪器a的名称__________。
(2)实验室用氯酸钾和二氧化锰制取氧气,可采用的发生装置为_______,发生反应的化学方程式是__________。若改用高锰酸钾制取氧气,发生装置应作的改动是_________。
(3)实验室制取二氧化碳的化学方程式为__________________________,若要制取一瓶二氧化碳,可采用的装置组合为_________,向集气瓶中倒入澄清石灰水,发现澄清石灰水溶液不变浑浊,造成这一现象的可能原因是____________________,若要使反应停止可采取的操作是__________________________。
(4)焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置I中产生气体的化学方程式为:H2SO4(浓)+Na2SO3═Na2SO4+SO2↑+H2O
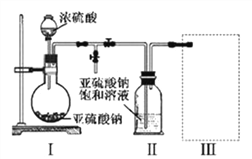
①装置Ⅱ中生成Na2S2O5晶体发生的是化合反应,其反应的化学方程式为:____________。
②Na2S2O5中硫元素的化合价是_____________。
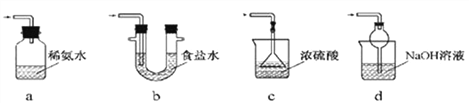
③装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为___________(填序号)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】完成下列化学方程式
(1)氧化铁与稀盐酸反应____________________
(2)氢氧化钠与三氧化硫反应____________________
(3)硫酸铜溶液与硝酸钡溶液反应____________________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学的学科特征是在原子、分子水平上研究物质和创造物质。请从微观角度回答下列问题:

(1)从Na、Mg原子结构示意图(如上图所示)推知,金属Na、Mg性质不同的原因是_______________;
(2)一氧化碳和二氧化碳性质不同的原因是_________________________________;
(3)NaOH溶液和Ca(OH)2溶液都能使酚酞溶液变红的原因是__________________。由此可见,物质的结构决定物质的性质。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室部分装置如下图所示,回答下列问题。
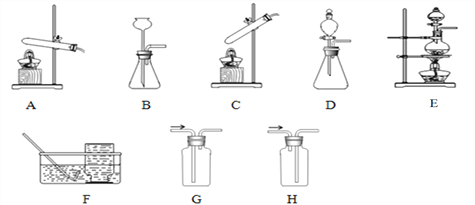
(1)实验室制取气体通过反应物状态,反应条件等选用相应的发生装置,根据气体的性质等选用相应的收集装置,请完成下表空格。发生装置、收集装置填字母。
气体 | 反应物、反应条件 | 化学方程式 | 发生装置 | 收集装置 |
O2 | 氯酸钾、二氧化锰固体、加热 | _____________ | 收集纯净的氧气用_______ | |
CO2 | 稀盐酸和大理石、常温 | _____________ | B或_______ | 收集干燥的二氧化碳用____________ |
Cl2 | 浓盐酸和二氧化锰固体、加热 | _____________ |
(2)氯气(Cl2)是有强烈刺激性气味的剧毒气体,能溶于水,与水反应生成______性物质,实验室用氢氧化钠溶液吸收尾气以免污染环境。为防止倒吸,选择______(下图,填字母,单选题)作为吸收氯气尾气的装置。
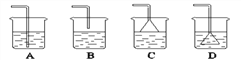
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙、丙三种物质的溶解度曲线如下图所示,根据图中信息回答下列问题:
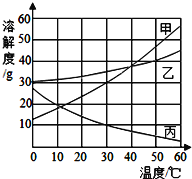
(1)50℃时,乙物质的溶解度是_________g。
(2)50℃时,将40g乙物质放入100g水中充分溶解后,所得溶液的溶质质量分数为______(精确到0.1%)。
(3)要使50℃时接近饱和的甲溶液变成该温度下的饱和溶液,可采用的一种方法是______。
(4)50℃时,将等质量的甲、乙、丙三种物质的饱和溶液同时降温至10℃,所得溶液的溶质质量分数由大到小的顺序为______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(8分)化学就在我们身边,它与我们的生活息息相关。
(1)下图为某食品包装袋的部分说明。
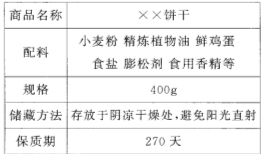
请回答下列问题:
①在饼干的配料中,富含油脂的是 ;
②配料中可用于腌渍蔬菜的物质是 ;
③小麦粉中富含糖类,糖类在人体内经过一系列的变化最终转化为水和 ;
④食用香精中含有香豆素(C9 H6 O2),香豆素中碳、氢、氧三种元素的质量比为 。
(2)现有H、C、O、Ca四种元素,请选用其中的元素写出符合下列要求的物质的化学式。
①最轻的气体 ;
②“西气东输”中“气”的主要成分 ;
③人体中含量最多的物质 ;
④可用作食品干燥剂的氧化物 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业废料石膏(CaSO42H2O)可以“变废为宝”,用于生产氧化钙、硫酸钾、电石(化学名称为碳化钙)等。某研究性学习小组展开了如下系列研究。
一.高纯CaO的制备
【资料一】
Ⅰ.无水硫酸铜遇水变成蓝色的硫酸铜晶体。
Ⅱ.石膏(CaSO42H2O)与碳粉高温煅烧生成氧化钙和几种气态非金属氧化物。
Ⅲ.SO2能使品红溶液褪色,也能使澄清石灰水变浑浊,还能被高锰酸钾溶液氧化而除去。
甲同学用如下装置制备CaO并验证石膏与焦炭高温反应的其他产物。

实验过程中发现:B中无水硫酸铜变蓝,C中产生_____________现象证明有SO2生成,装置_____中无明显变化和装置F中_____________现象证明有CO2生成。写出石膏与碳粉在高温条件下反应的化学方程式:___________________。
二.硫酸钾和电石的制备
乙同学模拟生产化肥硫酸钾和电石的流程如下:

【资料二】氧化钙与焦炭在高温下反应生成碳化钙和一氧化碳。
(1)反应①的化学方程式为__________________________。证明固体M中不含CaCO3的方法是____________________________(写出实验的方法、现象)。
(2)反应②的化学方程式为(NH4)2SO4 + 2KCl ═ K2SO4↓+ 2NH4Cl,该反应能析出K2SO4晶体的原因是_____________________________________。
(3)假设上述流程中制得的碳化钙(化学式为CaCx)固体中只含杂质CaO,乙小组同学为测定CaCx中x的值进行如下实验。
【资料三】碳化钙在空气中灼烧生成氧化钙和二氧化碳气体。
步骤一:称取3.76g样品于下图所示石英管中(测定装置图如下,夹持及加热装置省略),反应前缓缓通入空气,高温灼烧石英管中的样品至反应完全后继续缓缓通入空气,测得丙溶液的质量比反应前增重了4.4g。(玻璃纤维可防止固体粉末进入导管)

步骤二:将石英管内剩余固体全部转移到水中,加入足量碳酸钠溶液,经搅拌、过滤、洗涤、干燥等操作得到碳酸钙固体6克。试回答下列问题:
①装置甲的作用是_______。反应完全后继续缓缓通入空气的目的是_________。
②根据步骤一、二计算该样品中钙、碳、氧的质量比为______________,计算确定CaCx的化学式(请写出计算过程)________。
③应用:丙同学经查阅资料知道实验室常用电石(主要成分为碳化钙)与水反应制取乙炔气体(发生装置如图)。经实验发现,电石与水反应非常剧烈,为控制反应的速度以得到平稳的气流,下列改进方法可行的是______。
A.改长颈漏斗为分液漏斗或注射器 B.将电石研成粉末
C.将锥形瓶置于冰水浴中 D.用饱和食盐水代替水(电石与氯化钠不反应)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com