
分析 实验步骤:根据量筒的选择依据来分析;
数据处理:根据化学方程式以及氢氧化钠的质量来计算出醋酸的溶质质量分数结合标签来分析;
交流反思:(1)加水稀释时溶质的质量不变,并不会影响实验的结果;
(2)俯视时,量取的醋酸偏少;
(3)利用酚酞作指示剂鉴定反应是否恰好进行.
解答 解:实验步骤:量筒的选择应该是量程稍大且最接近的,故填:B;
数据处理:设参加反应的醋酸的质量为x,则
CH3COOH+NaOH═CH3COONa+H2O
60 40
x 45.0mL×1.0g/mL×1%
$\frac{60}{40}=\frac{x}{45.0mL×1.0g/mL×1%}$
x=0.675g
则该醋酸中,溶质的质量分数为$\frac{0.675g}{12mL×1.0g/mL}×100%$=5.625%>55,与标签相符;故填:5.625%;相;
交流反思:(1)因为实验的目的是测定醋酸的质量,加水稀释时溶质的质量不变,并不会影响实验的结果.
故答案为:无;稀释前后溶质质量不变;
(2)俯视时,量取的醋酸偏少,计算结果偏小,故填:偏低;
(3)由于是测定白醋中醋酸的含量,所以要滴入几滴酚酞试液作指示剂,酚酞试液遇酸不变色,遇碱变红色,根据指示剂颜色的变化来判断反应的进行情况,故答案为:滴入最后一滴氢氧化钠溶液时,烧杯中液体由无色变红色.
点评 此题是一道醋酸含量的探究题,利用题目所给的信息,结合日常所学即可解决问题,其中的数据处理是已知一个反应物求另一个反应物的计算,是化学方程式的基本计算类型.


科目:初中化学 来源: 题型:选择题
| A. | 碳酸钠的水溶液能使酚酞变红,所以碳酸钠属于碱 | |
| B. | 高锰酸钾中含有氧元素,所以高锰酸钾属于氧化物 | |
| C. | 水和双氧水的组成元素相同,所以它们的性质完全相同 | |
| D. | 水在通电条件下生成氢气和氧气,所以水是由氢、氧元素的组成的 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
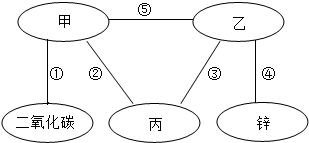 如图,甲、乙、丙分别是硫酸、氢氧化钙、氯化镁、碳酸钠四种物质中的某一种,“-”表示相连两种物质的溶液之间能发生化学反应,请回答下列问题:
如图,甲、乙、丙分别是硫酸、氢氧化钙、氯化镁、碳酸钠四种物质中的某一种,“-”表示相连两种物质的溶液之间能发生化学反应,请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
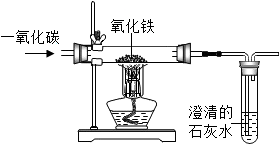
| A. | 实验现象:红色粉末变成黑色,澄清石灰水变浑浊 | |
| B. | 实验操作:加热前,应先通一会儿一氧化碳,以防爆炸 | |
| C. | 实验装置:为了减少空气污染,应增加尾气处理装置 | |
| D. | 实验原理:CO+FeO$\frac{\underline{\;高温\;}}{\;}$Fe+CO2 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 实验室剩余的药品不要随意丢弃,可拿回家继续做家庭实验 | |
| B. | 实验完毕,要及时洗净器皿,整理好实验用品,擦净桌面 | |
| C. | 实验中浓硫酸不慎沾到手上,应立即用水冲洗 | |
| D. | 将实验室制氧气后的废液经静置、过滤、晾干后可回收二氧化锰固体 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com