
| A. | ①④ | B. | ②③ | C. | ② | D. | ④ |
分析 根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
解答 解:①直接将混合物高温加热,碳与氧化铜高温下反应生成铜和二氧化碳,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的方法错误.
②CuO能与稀硫酸反应生成硫酸铜和水,炭粉不与稀硫酸反应,反而会把原物质除去,不符合除杂原则,故选项所采取的方法错误.
③CO能与氧化铜在加热条件下反应生成铜和二氧化碳,反而会把原物质除去,不符合除杂原则,故选项所采取的方法错误.
④在CO2气流中高温灼烧,二氧化碳能与炭粉反应生成一氧化碳,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确.
故选:D.
点评 物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.


科目:初中化学 来源: 题型:选择题
| A. | 二氧化碳灭火 | B. | 金刚石制玻璃刀 | ||
| C. | 铝制高压锅 | D. | 氮气用于食品防腐 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
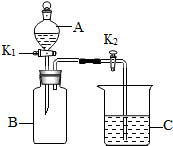 如图是初中化学中非常重要的装置.
如图是初中化学中非常重要的装置. 查看答案和解析>>
科目:初中化学 来源: 题型:解答题

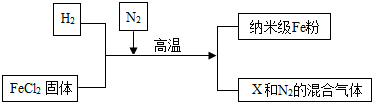
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 一个薄荷醇分子中含有31个原子 | |
| B. | 薄荷醇中碳元素的质量分数最大 | |
| C. | 薄荷醇的相对分子质量为156 | |
| D. | 薄荷醇中C、H、O三种元素的质量比为10:20:1 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 化学家谢赫特曼研究发现:铝锰合金晶体中的原子排列方式没有出现“规则有序而重复排列”的普遍现象,提出了“准晶体”概念,因此获得2011年诺贝尔化学奖.下列观点正确的是( )
化学家谢赫特曼研究发现:铝锰合金晶体中的原子排列方式没有出现“规则有序而重复排列”的普遍现象,提出了“准晶体”概念,因此获得2011年诺贝尔化学奖.下列观点正确的是( )| A. | 铝锰合金的强度和硬度比铝高 | |
| B. | 铝锰合金不具有导电导热性 | |
| C. | 铝的直接构成微粒是铝分子 | |
| D. | 合金中原子排列方式与纯金属的原子排列方式相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com