
 化学家谢赫特曼研究发现:铝锰合金晶体中的原子排列方式没有出现“规则有序而重复排列”的普遍现象,提出了“准晶体”概念,因此获得2011年诺贝尔化学奖.下列观点正确的是( )
化学家谢赫特曼研究发现:铝锰合金晶体中的原子排列方式没有出现“规则有序而重复排列”的普遍现象,提出了“准晶体”概念,因此获得2011年诺贝尔化学奖.下列观点正确的是( )| A. | 铝锰合金的强度和硬度比铝高 | |
| B. | 铝锰合金不具有导电导热性 | |
| C. | 铝的直接构成微粒是铝分子 | |
| D. | 合金中原子排列方式与纯金属的原子排列方式相同 |
分析 A、根据合金的性质进行分析判断.
B、根据合金具有金属的特性,结合合金的性质进行分析判断.
C、根据金属是由原子直接构成的,据此进行分析判断.
D、根据题意,铝锰合金晶体中的原子排列方式没有出现“规则有序而重复排列”的普遍现象,进行分析判断.
解答 解:A、合金的硬度和强度比组成它的纯金属的硬度大,铝锰合金的强度和硬度比铝高,故选项说法正确.
B、合金具有金属的特性,铝锰合金具有导电、导热性,故选项说法错误.
C、金属是由原子直接构成的,铝的直接构成微粒是铝原子,故选项说法错误.
D、铝锰合金晶体中的原子排列方式没有出现“规则有序而重复排列”的普遍现象,说明合金中原子排列方式与纯金属的原子排列方式不同,故选项说法错误.
故选:A.
点评 本题难度不大,了解合金的性质与用途、金属是由原子直接构成的等是正确解答本题的关键.


科目:初中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ② | D. | ④ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
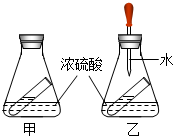 如图是小婧对硫酸的一些性质的探究,锥形瓶内的小试管盛装饱和的澄清石灰水.
如图是小婧对硫酸的一些性质的探究,锥形瓶内的小试管盛装饱和的澄清石灰水.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 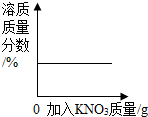 向饱和KNO3溶液中加入KNO3 | |
| B. | 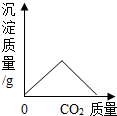 向CaCl2溶液中通入CO2 | |
| C. | 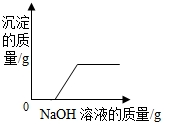 向CuCl2和HCl的混合溶液中加入过量NaOH溶液 | |
| D. | 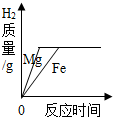 向两份同体积和同质量分数的HCl溶液中分别加入足量的铁粉和镁粉 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 自行车是比较常见的一种交通工具.制作自行车使用最多的金属是铁.铁在空气中往往容易生锈.人们为了防止铁制品生锈.在自行车的不同部位采取不同的防锈措施.例如:支架采取的防锈措施是刷漆,其防锈原理是隔绝氧气和水.
自行车是比较常见的一种交通工具.制作自行车使用最多的金属是铁.铁在空气中往往容易生锈.人们为了防止铁制品生锈.在自行车的不同部位采取不同的防锈措施.例如:支架采取的防锈措施是刷漆,其防锈原理是隔绝氧气和水.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
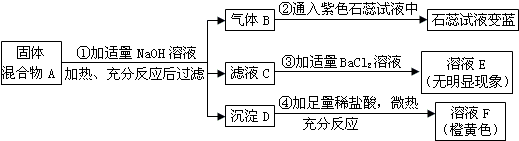
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
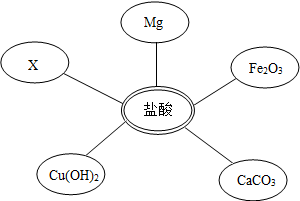
| 方案 | 加入试剂 | 提纯的方法 | 方案评价 |
| 一 | 适量Ca(NO3)2溶液 | 过滤、蒸发结晶 | (选填可行或不可行) |
| 二 | 稍过量的盐酸(或稀HCl或HCl) | 蒸发结晶 | 可行 |
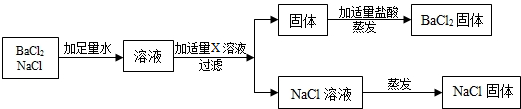
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com