
| 反应时间 | t0 | t1 | t2 | t3 |
| 烧杯和药品质量/g | 25.7 | 25.6 | 25.5 | 25.5 |
分析 (1)表中数据表明,第三次称得质量和第四次称得质量相等,说明在第三次称重时已完全反应,此时所称得质量为25.5g,与反应前的总质量=5.7g+10g+10g=25.7g相比,少了0.2g;由于反应中只放出氢气,所以生成氢气的质量为0.2g;生铁为铁和碳的混合物,其中碳不与盐酸反应,所得氢气质量为铁与盐酸反应所产生,根据铁与盐酸反应的化学方程式,已知氢气的质量可求出铁的质量,从而求出铁的含量.
(2)根据“(1)中的这种钢样品中铁的含量”计算出这种钢样品中含碳量,对照已知条件就可知道它属于哪一种钢
(3)根据碳和铁都与氧气反应的生成物质量的大小来判断
解答 解:(1)根据质量守恒,反应前后质量差即为氢气质量,生成氢气的质量=5.7g+10g+10g-25.5g=0.2g;
设5.7g钢样品中铁的质量为x
Fe+2HCl=FeCl2+H2↑
56 2
x 0.2g
$\frac{56}{x}=\frac{2}{0.2g}$
解得,x=5.6g
则这种钢样品铁的含量为:$\frac{5.6g}{5.7g}$×100%≈98.2%;
答:这种钢样品中铁的含量是98.2%;
(2)这种钢样品中含碳量为:1-98.2%=1.8%,0.6%<1.8%<2%,故这种钢属于高碳钢;
故答案是:高碳钢
(3)钢样灼烧时,钢样中的铁与氧气化合成铁的氧化物而使固体质量增大,碳与氧气化合成二氧化碳而使固体质量减小,由于碳减少的质量远小于铁转化为氧化物增加的质量.
故答案为:
(1)0.2g (2)高碳钢
(3)钢中含碳量少,碳减少的质量远小于铁转化为氧化物增加的质量
点评 本题是表格型的数据处理题,解题关键是通过四次称重的质量变化特点,判断出放入稀盐酸中的生铁样品完成反应,利用质量守恒定律,求出氢气质量


科目:初中化学 来源: 题型:解答题
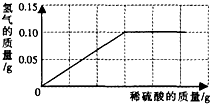 为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止.反应过程中生成的气体与所用硫酸溶液的质量关系如图所示.试计算:
为了测定黄铜(铜、锌合金)的组成,某研究性学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止.反应过程中生成的气体与所用硫酸溶液的质量关系如图所示.试计算:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 热固性塑料和热塑性塑料-加热,观察外形变化 | |
| B. | 用一氧化碳还原氧化铁留下的黑色物质可用稀盐酸浸泡除去 | |
| C. | 不用其它试剂就能鉴别出硫酸、氯化铁、氢氧化钡、氯化钾和氯化钡 | |
| D. | 为检验敞口放置在空气中的烧碱溶液是否完全变质可先用稀盐酸再用氯化钙溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com