
【题目】在2018全国两会上,农业部部长韩长赋在人民大会堂“部长通道”回答记者提问时说,农药和化肥确实对粮食增产发挥了重要作用,“十三五”开始,我国大力开展农药减量,效果明显。2016年,全国农药使用量负增长。
谈到农药,人们可能想到农药对人体健康和环境的危害,其实农药在农业生产上起着重要的作用。目前市售蔬菜农药残留量虽然已达到国家标准,但通过科学的清洗方法仍可进一步降低农药残留。
实验人员分别选取含甲、乙农药的蔬菜,研究了不同的清洗方法对农药的去除率的影响。
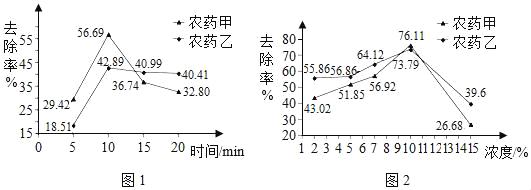
清水浸泡。图1呈现出两种农药的去除率随浸泡时间的变化。
洗洁精清洗。实验选择了6种洗洁精进行测试,结果表明多数洗洁精对农药的去除率可达到60%以上,最高可达到84%。
碱性溶液。浸泡食用碱溶液有利于农药分解,图2表示不同浓度的食用碱溶液对农药的去除率的影响。
希望同学们可以选择科学的清洗方法,更加安全的食用蔬菜。
依据文章内容,结合所学化学知识,回答下列问题。
(1)农药和化肥对粮食增产发挥了重要作用,请你写出一种氮肥:_____(合理即可)。
(2)依据图1分析去除农药残留的最佳浸泡时间是_____。
(3)食用碱主要是碳酸钠和碳酸氢钠,它们的溶液的pH_____7(填“>”或“<”)。测定溶液pH的正确方法是_____。
(4)用食用碱溶液浸泡含有农药甲的蔬菜时,要想超过清水浸泡的最大去除率,可以选取的浓度是_____(填序号,下同)。
A 2% B 5% C 10% D 15%
(5)下列说法正确的是_____。
A 采用清水浸泡去除农药的时间不宜过长
B 多数洗洁精对农药的清洗效果比清水浸泡的好
C 食用碱的去除效果较好,是因为在浸泡过程中农药发生了化学变化
【答案】碳酸氢铵(或氯化铵、硫酸铵、硝酸铵等合理即可) 10分钟 > 用玻璃棒蘸取待测溶液,滴在pH试纸上,把试纸显示的颜色与标准比色卡比较,读出待测溶液的pH C ABC
【解析】
(1)含氮元素的氮肥,可以是铵态氮肥,如碳酸氢铵;
(2)根据图1可以看到当时间在10分钟时去除农药的残留率达到峰值。
(3)碳酸氢钠和碳酸钠都是呈碱性的盐,pH大于7.测pH的具体方法是:用玻璃棒蘸取待测溶液,滴在pH试纸上,把试纸显示的颜色与标准比色卡比较,读出待测溶液的pH。
(4)图1中清水浸泡的去除率最大,为56.69%,根据图2可知,用食用碱溶液浸泡时,其浓度在10%时去除率达到峰值,超过了清水浸泡的最大去除率。
(5)A.由图示信息可知,采用清水浸泡去除农药的时间不宜过长,正确;
B.由题干信息可知,多数洗洁精对农药的清洗效果比清水浸泡的好,正确;
C.由图示信息可知,食用碱的去除效果较好,是因为在浸泡过程中农药发生了化学变化,正确。
故填:ABC;
故答案为:(1)碳酸氢铵(或氯化铵、硫酸铵、硝酸铵等合理即可);
(2)10分钟;
(3)>用玻璃棒蘸取待测溶液,滴在pH试纸上,把试纸显示的颜色与标准比色卡比较,读出待测溶液的pH;
(4)C;
(5)ABC。


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
【题目】小柯为比较Mg、Fe、Cu三种金属的活动性顺序,进行了如图甲所示的实验,实验后把两试管中的物质倒入烧杯中(如图乙)发现烧杯内的红色固体明显增多,充分反应后过滤。则滤液中含有的金属离子一定有( )
①Mg2+②Mg2+和Fe2+③Fe2+和Cu2+④Mg2+、Fe2+和Cu2+
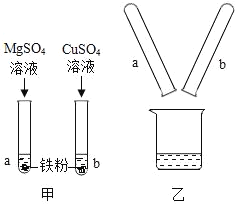
A. ①B. ②C. ③D. ④
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】11.2g某种铁合金样品(只含两种成分)与足量的稀硫酸充分反应后,生成0.44g氢气,则该铁合金中所含的另一种成分可能是( )
A.Cu B.Al C.Zn D.C
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】牙膏是人们生活中的必需品,在牙膏生产过程中常添加一种摩擦剂.这种摩擦剂是一种经过一系列加工而制得的极细的碳酸钙粉末.其生产过程如图.
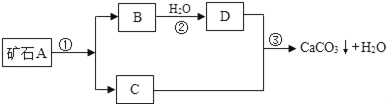
根据上图回答:
(1)写出B,C,两种物质的化学式:B_____; C_____;
(2)写出上述过程中反应①的化学方程式_____.上述过程中没有涉及的基本反应类型是_____
(3)许多牙膏中都含有_____元素,因为如果缺少这种元素,就容易得龋齿.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有合金![]() 与足量稀盐酸完全反应,产生
与足量稀盐酸完全反应,产生![]() 氢气,下列说法正确的是
氢气,下列说法正确的是![]()
![]()
A. 合金为Fe、Al B. 合金为A1、Zn C. 合金为生铁 D. 合金为Fe、Zn
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】味精是常用的调味品,它的鲜味来自于其中的主要成分“谷氨酸钠”(化学式是C5H8NO4Na,易溶于水,与AgNO3不反应),另外还含有NaCl,其它成分不考虑。请回答下列问题:
(1)味精中至少含有__________(填数字)种元素。
(2)称取5.0g味精配制成50g溶液,量取蒸馏水的量筒规格是_________(填字母)。
A.5mL B. 10 mL C. 50 mL D. 100 mL
(3)下图是配制过程,正确的操作顺序为_______(填字母) 。
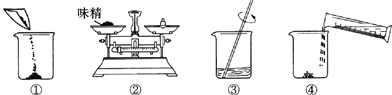
A.①②③④ B.②①④③ C.②④①③
(4)为测定NaCl在味精中的质量分数,进行如下实验:
①向所配制的50g溶液中加入AgNO3溶液充分反应,检验沉淀是否完全的方法是:静置后,在上层清液中加入______(填化学式)溶液,观察是否有沉淀生成。
②在其它操作均正确的情况下,若在配制溶液过程中,仰视刻度量取蒸馏水,则所配制溶液中,谷氨酸钠的质量分数____(填“偏大”、“偏小”或“无影响”),所测定的味精中NaCI的质量分数___(填“偏大”、“偏小”或“无影响”)。
③精确测定AgCl沉淀质量为2.87 g,则该味精中NaCl的质量分数为___。(计算结果精确到0.1%。有关物质的相对分子质量:NaCl-58. 5 , AgCl-143. 5 )
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A、B、C、D、E、F、G七种物质都是日常生活和生产中常见的物质,各物质间存在如下转化关系(反应的条件已省略):
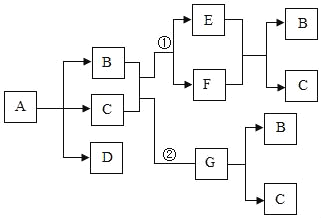
已知:B、C两种物质在不同情况下可分别发生①和②两个反应;A﹣G七种物质都是由非金属元素组成的,其中只有一种物质是盐,一种物质是单质;且B的相对分子质量大于C。
(1)请写出下列物质的化学式:A_____; G_____;
(2)请写出E+F→B+C的化学方程式:_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小华同学在探究金属与酸反应时,将铝片、锌片打磨后,分别投入盛有等体积、等浓度稀盐酸的试管中,观察到铝与稀盐酸反应较锌与稀盐酸反应快。
(提出问题)金属与盐酸反应快慢,除与金属的种类有关外,还受哪些因素的影响呢?
(猜想与假设)a.可能与盐酸的浓度有关;b.可能与反应时的温度有关;c.你的猜想是_____。
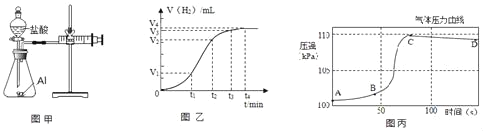
(设计并实验)小明利用如图甲所示装置,用不同质量分数的盐酸和相同形状的铝片进行如下实验。
实验编号 | 盐酸的浓度(均取20mL) | 温度/℃ | 记录的数据 |
① | 5% | 30 | |
② | 10% | 20 | |
③ | 5% | 20 | |
④ | 10% | 30 |
(交流讨论)(1)请写出铝与盐酸反应的化学方程式:_____。
(2)实验前小明先将分液漏斗的活塞关闭,再将注射器活塞往右拉,松手后,观察到注射器活塞回到原处。小明进行该操作的目的是_____。
(分析数据、得出结论)
(3)实验中记录的数据可能是:_____;
对比实验②③可知_____ 对金属与酸反应的速率的影响
(4)实验表明,四次实验时,反应的速率由快到慢依次为④、②、①、③.根据记录的数据分析,如果盐酸质量分数为10%,温度为25℃,则所记录数据应该介于_____两次实验所记录的数据之间。
(拓展延伸)
(5)小明进行铝与稀盐酸反应时,试管外壁发烫,并测得实验过程中生成氢气的体积随时间变化的曲线如图乙所示,根据曲线归纳铝与稀盐酸反应速率的变化规律:_____
(6)研究小组同学对铝和稀盐酸的反应进行再探究。将橡皮塞连接气体压力传感器,烧瓶中放入铝片和稀盐酸,塞紧瓶塞并打开仪器,一段时间后,得到如丙图所示的气体压强与时间的关系曲线图。
AB段气体压力变化不明显的原因是:_____。
CD段气体压力逐渐下降的原因是:_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是甲、乙两种固体物质的溶解度曲线。下列说法正确的是
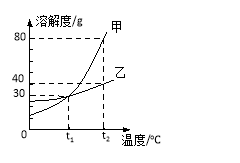
A.t1℃时,向100克水中加入20克甲,充分溶解后所得溶液是饱和溶液
B.甲饱和溶液从t2℃降温至t1℃,溶液的质量不变
C.乙饱和溶液温度降低,有晶体析出,是化学变化
D.当甲中含有少量乙时,可用降低甲饱和溶液温度的方法提纯甲
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com