
【题目】分析处理图表中的信息是学习化学的一种重要方法,运用溶解度表与溶解度曲线回答下列问题:
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
NH4Cl溶解度/g | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
NaCl溶解度/g | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
(1)氯化钠的溶解度曲线是 _________(填“甲”或“乙”)。
(2)20℃时,将40g NH4Cl加入100g的水中,充分搅拌后得到的是______溶液(填“饱和”或“不饱和”),将上述溶液升温到30℃,该溶液的溶质质量分数为_______(只列计算式,不需要计算结果)。
(3)如下图,t1℃时,将两种物质的饱和溶液各100g,分别恒温蒸发5g水,析出晶体最多的是______(填“甲”或“乙”)。

(4)计算配制50g质量分数为3%的NaCl溶液所需质量分数为6%的NaCl溶液的体积,需要用到的数据是_____________(填字母)。
A.3%的NaCl溶液的密度 B.水的密度 C.6%的NaCl溶液的密度
【答案】 乙 饱和溶液 ![]() 乙 C
乙 C
【解析】(1)从表中数据可看出,氯化钠的溶解度受温度影响不大,故乙是氯化钠的溶解度曲线。(2)20℃时,NH4Cl的溶解度是37.2g,即20℃时,100g水中最多能溶解37.2gNH4Cl,故将40g NH4Cl加入100g的水中,充分搅拌后得到的是饱和溶液。30℃时,NH4Cl的溶解度是41.4g,40gNH4Cl全部溶解,该溶液的溶质质量分数为: ![]() ×100%(3)将两种物质的饱和溶液各100g,分别恒温蒸发5g水,析出晶体的质量溶解在5g水中恰好饱和,因为t1℃时,乙的溶解度大于甲的溶解度,故析出乙的质量较多。(4)溶液稀释前后溶质的质量相等,溶质质量=溶质质量分数×溶液质量,题中给出了6%的NaCl溶液的体积,需要知道6%的NaCl溶液的密度,然后计算出6%的NaCl溶液的质量,故选C。
×100%(3)将两种物质的饱和溶液各100g,分别恒温蒸发5g水,析出晶体的质量溶解在5g水中恰好饱和,因为t1℃时,乙的溶解度大于甲的溶解度,故析出乙的质量较多。(4)溶液稀释前后溶质的质量相等,溶质质量=溶质质量分数×溶液质量,题中给出了6%的NaCl溶液的体积,需要知道6%的NaCl溶液的密度,然后计算出6%的NaCl溶液的质量,故选C。


科目:初中化学 来源: 题型:
【题目】碳在地壳中的含量不高,但它的化合物数量众多,而且分布极广。根据所学知识回答:

(1)图①为碳原子的结构示意图,碳原子最外层电子数为________,常温下碳的化学性质________,(填“活泼”或“不活泼”)。
(2)图②、③、④对应三种碳单质:图②单质的名称是________,图③单质的名称是________,图④单质的化学式是________。
(3)C为+4价,Cl为-1价,由C和Cl组成的化合物的化学式为________。
(4)实验室若选用图⑤装置制取二氧化碳,则需要改正的一点是________,请你写出用石灰石与稀盐酸反应制取二氧化碳的化学方程式________,将产生的二氧化碳气体通入澄清石灰水,反应的化学方程式是________。
(5)用制取的二氧化碳进行如下实验:
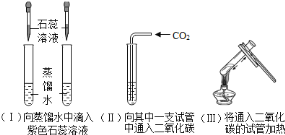
①实验(II)中溶液变________色。
②实脸(III)中加热之后溶液又变为________色,用化学方程式解释出现此现象的原因________。
(6)工业上高温煅烧石灰石(CaCO3)可制得生石灰(CaO)和二氧化碳。如果要制取10t氧化钙,需要碳酸钙多少吨______?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小明发现家里药箱中有一瓶无色液体,为了探究它是何种物质,他做了如下实验:① 此液体为A,在液体A中加入蓝色溶液 C(催化剂),稍微振荡,在常温下就能迅速产生气体B,且产生了常温下为液体的纯净物D; ② 将气体B收集起来,将带火星的小木条伸入盛有气体B的集气瓶中,小木条复燃。 ③把淡黄色粉末E点燃后放入盛有气体B的集气瓶中,E能剧烈燃烧,生成一种无色有刺激性气味的气体F。④把银白色的金属G点燃后伸入盛有气体B的集气瓶中,剧烈燃烧,火星四射,生成黑色固体H。
请根据小奇的实验,回答下列问题。
(1)写出各物质的名称或现象:D________; F________;在③中,燃烧发出_____________火焰。
(2)写出④中发生反应的文字表达式并注明基本反应类型:
_____________________________________________(___________)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如下粒子结构示意图得出的结论中,不正确的是
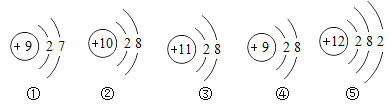
A. ①④属于同种元素 B. ③是阴离子,④是阳离子
C. ⑤易失去电子成为阳离子 D. ①属于非金属元素
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在 20℃时,将等质量的甲、乙两种固体分别加入盛有 100 g 水的烧杯中,充分搅拌后的现象如左图所示,甲、乙两物质的溶解度曲线如右图所示。则下列说法正确的是( )
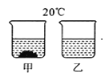
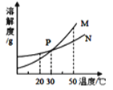
A. 烧杯甲中的溶液是N 溶液
B. 烧杯乙的溶液一定是不饱和溶液
C. 烧杯甲的溶液升温到 30℃时,烧杯底部还有部分物质不溶解
D. 若烧杯甲和烧杯乙的溶液都升温到 30℃时溶质的质量分数相等
查看答案和解析>>
科目:初中化学 来源: 题型:
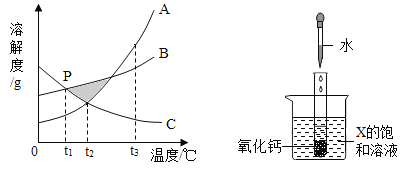
【题目】已知A、B、C三种物质的溶解度曲线如图所示。
(1)在阴影区域部分,处于不饱和状态的是__________(选填“A、B盐酸反应生成、C”)。
(2)若饱和A溶液中含有少量的C,提纯A的方法为______结晶,过滤。
(3)P点表示的含义为_________。
(4)在t1℃下,B、C的饱和溶液升温至t2℃,所得溶液溶质的质量分数大小关系为_______。
(5)向试管中滴入2mL水后,若X中有固体析出,则X为______(选填“A、B、C”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组对空气中氧气含量测定的再认识.
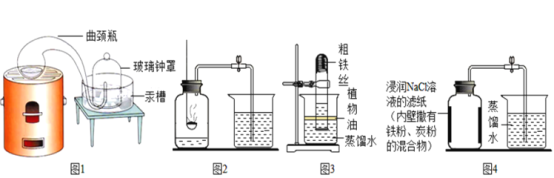
(经典赏析)教材中介绍了拉瓦锡用定量的方法研究了空气的成分(实验装置如图1)。
(1)下列有关该实验说法正确的是_______。
A.实验装置简单,加热时间短
B.汞槽中的汞可以起到液封作用
C.生成的红色粉末加热分解又能得到汞和氧气
D.能将密闭装置内空气中的氧气几乎耗尽
(2)通过该实验,拉瓦锡得出了空气是由氮气和氧气组成,氧气约占空气总体积的____。
(实验回顾)实验室常用红磷燃烧的方法测定空气中氧气的含量(装置如图2),写出红磷燃烧的文字或者符号表达式______________。兴趣小组用该方法测出的氧气含量12%,发现结果明显偏低,可能的原因是:(1)装置漏气;(2)___;(3)…
(结论与反思)多次实验证明红磷燃烧测定空气中氧气含量都明显低于21% ,通过查阅资料显示:当氧气的体积分数低于7%,红磷就要熄灭,无法将氧气耗尽,所以误差较大。
(实验探究1)已知铁生锈是与空气中的氧气和水发生化学反应的过程,生成一种暗红色的固体。小明根据铁生锈的原理,探究用铁能否准确测定空气中氧气的含量,于是进行了实验(装置如图3),通过7天测得的数据计算空气中氧气的含量为19.13%。
(交流与反思)实验结束后能观察到的现象是铁丝表面有暗红色物质生成、试管内液面_______(填“上升”“下降”或“不变”)。
与用红磷燃烧的方法相比,用铁丝生锈的方法测定空气中氧气的含量的主要优点是:___________________________。
(实验探究2)为了加快反应速率,小明通过查阅资料,利用铁粉、炭粉、氯化钠、蒸馏水等物质又进行了实验(装置如图4),8分钟后测得的数据如表:
实验前的体积 | 实验后的体积 | |
集气瓶内空气 | 烧杯内蒸馏水 | 烧杯内剩余蒸馏水 |
130mL | 90.0mL | 63.6mL |
请计算出空气中氧气含量_____________(计算结果保留一位小数)
(结论与反思)通过上述实验探究,利用铁粉比铁丝可快速地完成实验并减小实验误差,你认为可能的原因是_______(填序号);
A.相同条件下,铁粉与反应物间有更大的接触面积,能使反应更快速充分
B.两者是不同物质,铁粉的化学性质更活泼,更容易与氧气反应
实验中炭粉、氯化钠能明显加快反应速率,则它们在反应中所起的作用可能是______作用。
(拓展延伸)常温下铜能与氧气、水、二氧化碳反应而锈蚀,生成铜绿(Cu2(OH)2CO3),写出该反应的文字或符号表达式_______,但若缺少其中一种物质则铜不会锈蚀。若将图3装置中的粗铁丝换成足量的铜丝进行实验,请判断能否比较准确地测定空气中氧气的含量,并说明理由_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是某空间站能量转化系统局部示意图,其中水电解系统及燃料电池系统中的溶液均采用氢氧化钠溶液。下列有关说法错误的是
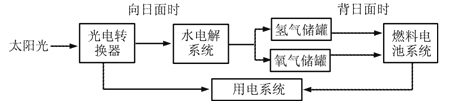
A. 该能量转化系统中的水可以循环使用
B. 水电解系统中负极产生的气体可作燃料使用
C. 水电解系统中的溶液采用氢氧化钠溶液,是为了增强水的导电性
D. 燃料电池系统产生的能量实际上来自于水
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为了测定某黄铜(铜锌合金)样品中铜的质量分数(不考虑黄铜中的其他杂质),现将30g稀盐酸分三次加入到10g黄铜样品粉末中,每次充分反应后,测定生成气体的质量数据见下表:
第一次 | 第二次 | 第三次 | |
加入稀盐酸的质量/g | 10 | 10 | 10 |
生成氢气的质量/g | 0.08 | m | 0.04 |
试求:
(1)m=______________;
(2)此黄铜样品中铜的质量分数________;
(3)请画出随着稀盐酸的加入,生成氢气的质量关系图__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com