
| 产品标准号: | GB5461-2000 |
| 配料 | 食盐、碘酸钾、抗结剂 |
| 质量等级 | 一级 |
| 碘含量 | 35±15mg/kg |
| 食用方法 | 待食品熟后加入碘盐 |
| 储藏方法 | 密封储存、防潮加热 |
| 分装日期 |
分析 (1)根据碘元素与人体健康之间的关系分析判断;
(2)根据碘酸钾的组成分析判断.
(3)根据碘酸钾的化学式计算.
(4)根据初中生每天碘元素适宜摄入量和食盐的含碘量分析计算.
解答 解:解:(1)呆小症是由于幼年时期甲状腺激素分泌不足而导致的,患者身材矮小,智力低下,生殖器官发育不全.
(2)碘酸钾是由不同种元素组成的纯净物,属于化合物;
(3)设食盐厂家应该在1kg食盐中加入碘酸钾的质量为xmg,则
xmg×$\frac{127}{39×1+127+16×3}$×100%=35mg 解得:x=59mg
(4)一天最多可以摄入含碘量为35mg/kg的食盐的质量是:$\frac{0.15mg}{35mg/kg}$=0.0043kg=4.3g.
故答为:(1)C;(2)B; (3)59; (4)4.3.
点评 本题考查学生利用信息中物质的化学式进行简单计算,学生应注重与所学知识的结合来解答,本题还注重了化学与生活的联系,可让学生认识生活中的化学知识,加强学习兴趣的引导.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:初中化学 来源: 题型:填空题
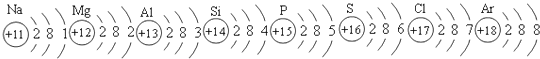
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
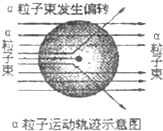 1911年著名物理学家卢瑟福为探索原子的内部结构进行了实验.在用一束带正电的、质量比电子大得多的高速运动的α粒子轰击金箔时发现:
1911年著名物理学家卢瑟福为探索原子的内部结构进行了实验.在用一束带正电的、质量比电子大得多的高速运动的α粒子轰击金箔时发现:| A. | 原子内部有很大的空间 | B. | 原子核带正电 | ||
| C. | 原子核体积很大 | D. | 原子是实心的球体 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 编号 | KClO3质量(g) | 加入物质质量(g) | 待测数据 |
| 1 | 2.0 | CuO x | |
| 2 | 2.0 | MnO2 0.5 |
| 实验步骤 | 设计这一步骤的目的 |
| 实验表明,加入CuO后产生O2的速率比未加入时快得多 | CuO能加快KClO3的分解 |
| 将加热后残留的固体溶于足量的水,过滤后称重CuO的质量 | CuO的质量在反应前后是否保持不变 |
| 将过滤后的CuO重新与KClO3混合加热,观察是否依旧能加快KClO3的分解(或者利用CuO的常见化学性质如:将CuO加入稀硫酸中,观察无色溶液是否变成蓝色) | CuO的化学性质在反应前后是否保持不变 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com