
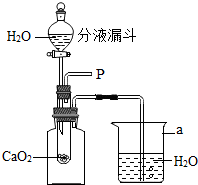
 小强在回家的途中经过一鱼塘边时,发现养鱼师傅向鱼塘中撒一种微黄色的固体,鱼塘中顿时产生大量气泡,经咨询得知,这种固体的主要成分是过氧化钙(CaO2),请你与小强共同探究.
小强在回家的途中经过一鱼塘边时,发现养鱼师傅向鱼塘中撒一种微黄色的固体,鱼塘中顿时产生大量气泡,经咨询得知,这种固体的主要成分是过氧化钙(CaO2),请你与小强共同探究.| 实验步骤 | 可能出现的现象 | 结论 |
| 取反应后所得的溶液样品滴入酚酞指示剂(或通入CO2 气体) | 变红(或产生白色浑浊) | CaO2与H2O反应有Ca(OH)2生成 |
| / | CaO2与H2O反应无Ca(OH)2生成 |
分析 本题主要围绕过氧化钙与水的反应进行反应生成物的探究,为探究生成物,题中设计了生成物之一氢氧化钙的检验.
(1)氧气的检验,对实验的意义进行评价,常见仪器的识别;
(2)根据质量守恒定律,对反应的生成物进行合理的猜想,结合物质的性质对猜想做出评价;
(3)归纳探究过程,总结反应的化学方程式;
(4)对实验过程中所出现的现象进行分析,归纳出反应的特点.
解答 解:(1)能使带火星木条复燃的气体一定是氧气,氧气不易溶于水、可以维持呼吸,为使水中鱼持续获得氧气,需要不断向水中补充氧气.
故答:氧气,补充鱼塘中的氧气,烧杯;
(2)氧化钙极易与水反应生成氢氧化钙,因此,氧化钙不能在水中存在.
故答:在水较多的环境中即使生成CaO,也会和水作用生成Ca(OH)2;
氢氧化钙溶于水溶液呈碱性,滴入酚酞试液会变成红色;向氢氧化钙溶液通入二氧化碳会出现浑浊.
故答:
| 实验步骤 | 可能出现的现象 | 结论 |
| 取反应后所得的溶液样品滴入酚酞指示剂(或通入CO2 气体) | 变红(或产生白色浑浊) | CaO2与H2O反应有Ca(OH)2生成 |
点评 根据质量守恒定律,对反应的生成物进行合理的猜想,结合物质的性质对猜想做出评价.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验 | 实验内容 | 实验操作 | 实验现象 |
| ① | 硫在空气中燃烧 | 在燃烧匙里放少量硫,加热,直到发生燃烧 | 发出微弱的淡蓝色火焰,生成刺激性气味气体,放热 |
| ② | 硫在氧气中燃烧 | 把盛有燃着的硫的燃烧匙伸进充满氧气的集气瓶中 | 发出明亮的蓝紫色火焰,生成刺激性气味气体,放热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com