
【题目】(9分)下图是实验室常用的实验仪器与装置,根据所学知识回答下列问题:
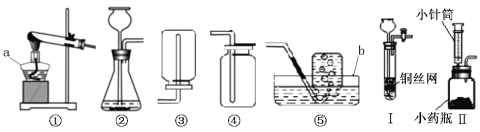
(1)写出图中编号仪器名称:a 、b ;
(2)用高锰酸钾制取氧气时,反应的化学方程式为 ,所选用的收集装置是 (填装置序号);
(3)实验室用锌粒和稀硫酸反应制取氢气,则①~⑤选用的发生装置为 (填装置序号);
(4)小波同学将装置②进行了改进,如图Ⅰ和Ⅱ。改进后的装置与装置②相比,装置Ⅰ的优点
是 ,装置Ⅱ的优点是 ;
(5)实验室若用装置Ⅰ制取二氧化碳,铜网上常放置的药品应为 (填名称),其反应的化学方程式为 。
【答案】(1)①酒精灯 水槽 (2)2KMnO4 △K2MnO4 + MnO2 + O2↑ ④或⑤
(3)② (4)可以随时控制反应的发生和停止 可以控制反应的速率
(5)石灰石或大理石 CaCO3+2HCl==CaCl2+H2O+CO2↑
【解析】
试题分析:(1)常见仪器的识记
(2)实验室用高锰酸钾制取氧气时,反应的化学方程式为:2KMnO4 △K2MnO4 + MnO2 + O2↑,气体收集装置的选择依据:生成气体的密度和溶解性(氧气的密度比空气大且不易溶于水),故收集氧气的装置应选择④或⑤
(3)气体发生装置的选择依据:反应物的状态和反应条件,实验室用锌粒和稀硫酸反应制取氢气,是固体和液体在常温下反应,故选用的发生装置为②
(4)改进后的装置与装置②相比,装置Ⅰ可以通过活塞的开关,从而控制固体与液体分离,故装置的优点是:可以随时控制反应的发生和停止,而装置Ⅱ的优点是:可以通过控制小针筒滴加液体的速率,从而可以控制反应的速率
(5)实验室若用装置Ⅰ制取二氧化碳,铜网上常放置的药品应为:石灰石或大理石,其反应的化学方程式为:CaCO3+2HCl==CaCl2+H2O+CO2↑


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
【题目】有一包固体粉末,可能含有氧化钙、氯化钠、碳酸钠、硫酸钠中的一种或几种。为确定其组成,小杨设计出实验方案,实验步骤及现象如下。请回答:
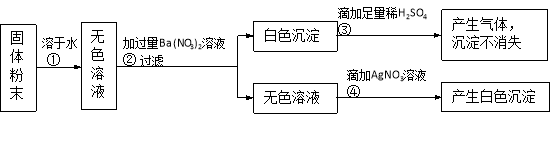
(1)写出步骤④中产生白色沉淀的化学方程式______。
(2)根据实验中的现象,能否确定原固体粉末的组成?若能,请写出各成分的化学式;若不能,在原实验步骤的基础上,对上述方案中的试剂作一改进,并描述相应的实验现象及结论,以确定固体粉末的组成。____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知铜可以和浓硝酸发生如下反应:Cu + 4HNO3(浓) = Cu(NO3)2 + 2H2O + 2NO2↑,实验室可以通过该反应制取二氧化氮气体。NO2是一种红棕色气体,密度比空气大,能和水反应。NO和NO2都是空气的污染物。现给出下列装置:
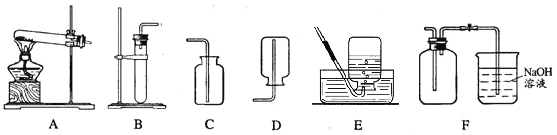
(1)某同学做该实验时,有失去标签的浓硝酸和浓盐酸,如何区分出浓硝酸?
(2)制取NO2的发生和收集装置应分别选用 和 。请写出利用你选择的发生装置制取另一种气体的反应方程式。
(3)随着反应的进行能产生NO气体,请解释可能的原因?
(4)已知NO密度比空气略大,难溶于水,NO能与氧气反应生成NO2,应选用装置 收集NO,并写出NO和氧气反应的化学方程式。
(5)某同学做完实验后,为回收废液中的金属铜,向废液中加入28g铁屑,恰好完全反应。请计算回收到的铜的质量。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(4分)A-G和X都是初中化学中的常见物质,其中A、C、E是无色气体,B是红棕色固体,X为蓝色溶液,它们的转化关系如下图所示(部分反应物、生成物已省略):
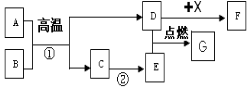
(1)G的化学式是 ;
(2)写出反应①的化学方程 ;
(3)写出在自然界普遍存在反应②,其名称为
(4)D与X充分反应后过滤后得滤渣F,在滤渣F中加入稀盐酸,有气泡产生,则滤渣的成分是 ____ 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列物质的用途主要由物理性质决定的是( )
A.镁粉用于制作照明弹 B.钨用于制作白炽灯丝
C.生石灰做食品干燥剂 D.氮气用作焊接金属时的保护气
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(5分)我国是铝生产大国,铝生产是以铝土矿为原料,经过纯制和电解过程生产而
成,以下是生产铝的主要工艺流程及工艺介绍。
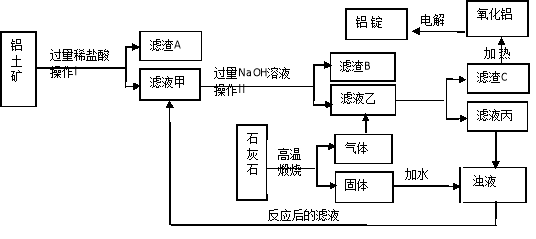
纯制工艺:就是先将铝土矿(主要成分是Al2O3,含有Fe2O3、MgCO3等杂质)分别用稀盐酸和氢氧化钠溶液溶解,去除杂质和获得偏铝酸钠溶液,然后向偏铝酸钠溶液中通入过量的CO2以便得到高纯度的Al(OH)3。
电解工艺:通电分解由Al(OH)3加热分解而成的Al2O3 。
根据以上图解和介绍,请回答下列相关问题:
(1)生产流程中的操作Ⅰ、Ⅱ名称是 。
(2)铝土矿中加入过量稀盐酸会发生多个反应,其中的一个反应的化学方程式是 。
(3)滤液甲、滤液乙分别于NaOH和CO2反应的化学方程式是: 4NaOH+AlCl3=X(偏铝酸钠)+3NaCl+2H2O、 2X+CO2+3H2O=2Al(OH)3↓+Na2CO3 这两个化学方程式中X的化学式为 。
(4)最终制得铝的化学方程式是 。
(5)为节约成本减少浪费整个生产流程中可进行循环使用的主要物质是
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某研究性学习小组设计了测定纯碱(Na2CO3)样品(只含NaCl杂质)中Na2CO3质量分数的实验方案.请回答下列问题:
小资料:碱石灰的主要成分是氢氧化钠和氧化钙的混合物
(1)气体法。
【原理思路】利用Na2CO3与稀硫酸反应产生CO2,通过测量丙装置实验前后的质量得出CO2质量,从而计算碳酸钠的质量分数。(不考虑原装置内空气的影响)
【实验分析】小科同学根据以上思路,设计了如下图的实验装置。
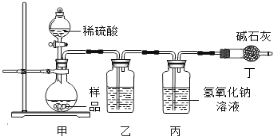
①实验装置乙中盛放的试剂为 。
装置丁中碱石灰的作用是 。(填字母)
A.吸收Na2CO3与稀硫酸反应产生CO2
B.防止外界空气中二氧化碳进入丙中
C.干燥二氧化碳
②实验中如果滴加稀硫酸的速度过快,会导致测得样品中碳酸钠的
质量分数 (填写“偏高”“偏低”或“不变”).
③小明同学认为小科的方案存在问题,即使操作规范下也会造成结果偏低,你认为他的理由是 ,应该将装置甲中双孔橡胶塞换成三孔橡胶塞,并增加下图装置,实验结束后缓缓通入一段时间空气,目的是 ,其中NaOH溶液的作用是 。
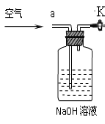
(2)沉淀法.
【实验原理】利用碳酸根离子与钙离子结合生成沉淀,通过沉淀的质量而得出碳酸钠的质量分数。
【实验步骤】①用托盘天平称取样品11.0g放入烧杯中,加水使其完全溶解;
②加入过量的CaCl2溶液充分反应。证明CaCl2过量(即Na2CO3已完全反应)的方法是: 静置,向上层清液中滴加 溶液,如果没有白色沉100%=96.4%淀生成,证明CaCl2过量;
③过滤、操作X、干燥、称量沉淀的质量为10.0g,操作X的名称是 ,如果缺少此操作会造成碳酸钠质量分数 (填写“偏高”“偏低”或“不变”)。
④通过以上提供的数据计算出样品中碳酸钠的质量分数为 。(写出计算过程,结果保留至0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】除去下列物质中的少量杂质,所选用的试剂正确的是( )
选项 | 物质 | 杂质 | 试剂 |
A | FeCl2 | CuCl2 | 铁粉 |
B | CO2 | HCl | 氢氧化钠溶液 |
C | NaCl | Na2CO3 | 稀硫酸 |
D | CuO粉 | Cu | 稀盐酸 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列物质的性质和用途表述没有直接联系的是
选项 | 性质 | 用途 |
A | 活性炭有吸附性 | 用作水的净化 |
B | 氮气无色无味 | 用作保护气 |
C | 氢气有可燃性 | 用作燃料 |
D | 氧气有助燃性 | 用作气焊 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com